Xanthomonas campestris
Strona Microbial Biorealm o rodzaju Xanthomonas campestris
Klasyfikacja
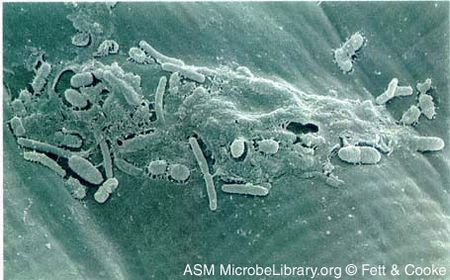
Courtesy of Fett & Cooke, ASM MicrobeLibrary
Taksony wyższego rzędu
Bakterie
Proteobacteria
Gamma Proteobacteria
.
Xanthomonadales
Xanthomonadaceae
Xanthomonas
Xanthomonas campestris
Gatunki
NCBI: Taxonomy
Xanthomonas campestris
Opis i znaczenie
Xanthomonas campestris jest tlenowym, Gram-ujemnym prętem znanym z wywoływania czarnej zgnilizny u krzyżowych poprzez ciemnienie tkanek naczyniowych. Ponad 20 różnych patotypów X. campestris zostało zidentyfikowanych na podstawie ich charakterystycznej patogeniczności dla szerokiej gamy roślin, w tym roślin uprawnych i dziko rosnących. Bakteria ta jest mezofilna z optymalną temperaturą 25-30 stopni Celsjusza (77-85 stopni Fahrenheita) i nieaktywna w temperaturze poniżej 10 stopni Celsjusza (50 stopni Fahrenheita). X. campestris mają Hypersensitive odpowiedzi i patogenności (Hrp) pili, które pomagają przenieść białka efektorowe w celu zmniejszenia obrony gospodarza i ślizgać się przez wodę. Mogą one żyć w glebie przez ponad rok i rozprzestrzeniać się przez każdy ruch wody, w tym deszcz, nawadnianie i wody powierzchniowe. Rozpylanie zdrowych roślin z fungicydami miedzi może zmniejszyć rozprzestrzenianie się bakterii w polu . Jednakże, gdy roślina zostanie zainfekowana, X. campestris ostatecznie rozprzestrzeni się na łodygę nasienną hamując wzrost zdrowego potomstwa.
Przez czystą fermentację kulturową, X. campestris może wytwarzać zewnątrzkomórkowy polisacharyd znany jako guma ksantanowa, która jest komercyjnie produkowana jako środek stabilizujący stosowany w wielu produktach codziennego użytku, w tym sosie sałatkowym lub paście do zębów. X. campestris jest organizmem modelowym do badania interakcji pomiędzy roślinami i bakteriami. Ze względu na deficyt w uprawach, dalsze badania tej bakterii są w toku w nadziei, że dowiemy się, jak uodpornić rośliny na ten patogen.
Struktura genomu
Struktury genomu X. campestris zawierają zmienność w zależności od patotypów. Jednakże różne szczepy X. campestris wykazują podobne cechy, takie jak koliste chromosomy, ruchome elementy genetyczne i sekwencje kodujące białka. W 2002 roku opracowano kompletny genom X. campestris pv campestris (Xcc) str. ATCC 33913 zawierał ponad 5,076,188 nukleotydów, które kodują ponad 4200 kodujących białek i 61 strukturalnych RNA. Z ponad 548 unikalnymi sekwencjami kodującymi, X. campestris pv. vesicatoria (Xcv) składa się z 5,17-Mb kolistego chromosomu, czterech plazmidów i niezbędnego dla patogenności systemu sekrecji białek typu III. Używając Recominbase-based In Vivo Expression Technology do celowania w pomidora, stwierdzono, że Xcv ma 61 genów, które są zaangażowane w interakcję między patogenem a gospodarzem, w tym niezbędny transporter wirulencji, gen homologu citH .
Struktura komórkowa i metabolizm
X. campestris jest Gram-ujemną bakterią w kształcie pręta, charakteryzującą się dwiema ścianami komórkowymi i żółtym pigmentem. Posiada nitkowatą strukturę zwaną nadwrażliwością i patogennością (Hrp) pili, która jest dołączona do systemu wydzielania białek typu III wdrażającego zdolność do przenoszenia białek bakteryjnych na rośliny, a także ruchliwość w wodzie.
Ta bakteria aerobowa wykonuje szereg szlaków metabolicznych, które są unikalnie zależne od patowaru. Sekwencjonowanie całego genomu Xcv wykazuje metabolizm węglowodanów, który obejmuje: Glikolizę / Glukoneogenezę, Cykl cytrynianowy (cykl TCA), Szlak fosforanu pentozy i inne. Xcv uzyskuje swoje źródło energii poprzez fosforylację oksydacyjną, wiązanie węgla, metabolizm metanu, azotu i siarki.
X. campestris pozyskuje węgiel od gospodarza przekształcając go w glukozę poprzez glukoneogenezę. Dalsze badania wykazały, że w glukoneogenezie Xcc zawiera tylko szlak enzymu jabłkowego-PpsA, który jest niezbędny dla wirulencji. Ponadto, ten patogen roślinny zawiera system sekrecyjny typu III (TTSS), który jest niezbędny do ataku na gospodarza. TTSS jest ważny w patogenezie, ponieważ przenosi białka efektorowe w celu obniżenia obrony gospodarza. Tworząc biofilm na powierzchni roślin, X. campestris jest przykładem komunikacji komórka-komórka poprzez dyfuzyjny czynnik sygnałowy (DSF).
Posiadając zdolność do fermentacji, X. campestris tworzy zewnątrzkomórkowy polisacharyd, ksantan, który jest produkowany komercyjnie i stosowany w różnych produktach codziennego użytku jako środek stabilizujący . Zobacz Zastosowanie w biotechnologii, aby uzyskać więcej szczegółów.
Ekologia
X. campestris powoduje duże straty w rolnictwie ze względu na ich siedlisko w roślinach. Może żyć w glebie przez ponad rok i rozprzestrzeniać się przez napowietrzne nawadnianie i wody powierzchniowe. Ta bakteria rozwijać się szczególnie podczas mokrej i ciepłej pogody z optymalną temperaturą na 25-30 stopni Celsjusza (77-85 stopni Fahrenheita). X. campestris zależy od wody, aby przetrwać i przenieść się do następnego gospodarza. Ze względu na zanieczyszczenie podczas operacji kulturowych, dotknięte rośliny zwykle występują w tych samych rzędach podczas hodowli . Zobacz patologię, aby uzyskać więcej szczegółów.
Patologia

X. campestris można rozpoznać po czarnych zmianach, które rozwijają się na powierzchniach roślin, gdy są zakażone. Patogen najpierw wchodzi w interakcję z gospodarzem, wydzielając szereg białek efektorowych, w tym białka reakcji nadwrażliwości wykorzystujące system sekrecji typu III (TTSS). Te efektory mogą zachowywać się awirulentnie, maskując się i wydzielając kilka białek reakcji nadwrażliwości i białek zewnętrznych, aby umożliwić interakcję z komórkami gospodarza. X. campestris celuje następnie w tkankę naczyniową powodując ciemnienie i chlorozę brzeżną liści. Bakteria przenika do wnętrza liścia w kierunku aparatów szparkowych, hydathodów i do komórek epidermy inicjując nowe zmiany. Silna infekcja występuje u młodych siewek. Ponieważ choroba postępuje w całej roślinie, główna łodyga nie może się uformować, co hamuje rozwój i powoduje czernienie żył. Ostatecznie bakterie rozprzestrzeniają się w całym systemie naczyniowym i w łodydze nasiennej, powodując zakażenie nasion przyszłymi chorobami.
Występujące bardziej podczas mokrych pór roku, X. campestris posiadają pili, które umożliwiają ruch ślizgowy przez mokre liście. Pokrywając dotknięty obszar w licznych liczbach, gdy roślina jest chora, patogen będzie rozprzestrzeniać się w każdej formie ruchu wody, w tym rozpryski kropli deszczu do nowego gospodarza.
Faktory wirulencji składają się z enzymów litycznych, które atakują ścianę komórkową rośliny, wydalanie proteaz, amylaz, celulaz i lipaz, które pomagają obniżyć mechanizmy obronne rośliny. Ponadto, klaster genów Rpf jest również kluczowy dla patogenezy, aby X. campestris mógł moderować produkcję tych wirulentnych czynników .
Zastosowanie w biotechnologii
X. campestris fermentuje środek stabilizujący zwany gumą ksantanową, który jest używany w wielu produktach codziennego użytku. Po raz pierwszy została ona wyprodukowana komercyjnie w Kelco Company, dużej firmie farmaceutycznej. Ten polisacharyd jest składnikiem produktów takich jak Kraft francuski opatrunek, Weight Watchers żywności, Wonder Bread produktów, i więcej . Z fermentacji węglowodanów przez X. campestris, guma ksantanowa jest pseudoplastyczne, łatwo miesza się właściwości pozwala mu być stosowany jako zagęszczacz poprzez zwiększenie lepkości cieczy . Ponadto guma ksantanowa przedłuża żywotność szybów naftowych i gazowych nawet po zakończeniu wydobycia. Albo pompowane do ziemi lub za pomocą wysokociśnieniowego piaskowania, mieszanie wody i gumy ksantanowej do studni pomoże zagęścić ciecz do uwolnienia produktów surowych ropy naftowej i przeciąć skały w gazowych i naftowych studni. Guma ksantanowa kosztuje 7 dolarów za funt w porównaniu do skrobi kukurydzianej za 89 centów za funt.
Bieżące badania
8.1 Kontrola biologiczna za pomocą szczepów Bacillus
Sekwencjonowanie genomu jest wykonywane w poszukiwaniu istotnych genów potrzebnych do opracowania odpornych roślin. Przeprowadzono eksperyment z wykorzystaniem szczepów Bacillus, w tym B. cereus, B. lentimorbus i B. pumilus, jako konkurentów patogenu Xcc w kapuście. Dowody wykazały pewne nadzieje na kontrolę biologiczną, gdy szczep Bacillus został dodany do korzeni .
8.2 Sieć regulacyjna dla komunikacji komórka-komórka
Ostatnie badania wykazują, że X. campestris używa dyfuzyjnego czynnika sygnałowego (DSF) do komunikacji komórka-komórka. Aby mikrokolonie mogły utworzyć strukturalny biofilm, wymagana jest synteza DSF z klastra czynnika regulacji patogenności (Rpf). Klaster Rpf zawiera geny niezbędne do zaistnienia patogenezy. Bez krytycznej sygnalizacji DSF, Xcc będzie tworzyć nieuporządkowany biofilm bakterii. Prowadzone są dalsze badania, aby zrozumieć, jak monitorowana jest sieć regulacyjna .
8.3 Zmienność genetyczna w dzikich krzyżownikach
Badacze znaleźli różnorodność genetyczną w Xcc na dzikich krzyżownikach. Ze względu na najbardziej zróżnicowane i obfite występowanie dzikich roślin krzyżowych na świecie, w Kalifornii przeprowadzono badania mające na celu znalezienie różnic w szczepach genetycznych Xcc w zainfekowanych dzikich chwastach. Z obszarów zarówno nieuprawnych, jak i uprawnych, wyizolowano Xcc z różnych regionów Kalifornii. Wykorzystując polimorfizm długości fragmentów amplifikowanych PCR (AFLP) do identyfikacji zmienności genetycznej szczepów, zsekwencjonowano ponad 72 szczepy, co wykazało 7 unikalnych genotypów, które były ograniczone do odpowiednich miejsc. Nieuprawiane dzikie chwasty w pobliżu wybrzeża posiadały szczepy Xcc, które były specyficzne dla tego regionu i różniły się od chwastów uprawianych w pobliżu obszarów produkujących rośliny uprawne.
Referencje
Averre, Charles W. „Black Rot of Cabbage and Related Crops” Dostęp 16 sierpnia 2007.
Ritchie David F, Averre Charles W. „Bacterial Spot of Pepper and Tomato”. North Carolina State University College of Agriculture and Life Sciences. Dostęp 20 sierpnia, 2007.
Weber E, Ojanen-Reuhs T, Huguet E, Hause G, Romantschuk M, Korhonen TK, Bonas U, Koebnik R. „The type III-dependent Hrp pilus is required for productive interaction of Xanthomonas campestris pv. vesicatoria with pepper host plants”. Journal of Bacteriology. 2005. Volume 187(7) p.2458-69.
Kuntz, L. „X is for Xanthan Gum”. Food Product Design. Accessed on August 26, 2007.
Vorhölter FJ, Thias T, Meyer F, Bekel T, Kaiser O, Pühler A, Niehaus K. „Comparison of two Xanthomonas campestris pv. campestris genomes revealed differences in their gene composition”. Journal Biotechnology. 2003. Tom 106(203). s.193-202.
„Xanthomonas campestris pv. campestris str. ATCC 33913, complete genome”. Public Library of Science Biology. 2002. Accessed on August 25, 2007.
Thieme F, Koebnik R, Bekel T, Berger C, Boch J, Büttner D, Caldana C, Gaigalat L, Goesmann A, Kay S, Kirchner O, Lanz C, Linke B, McHardy AC, Meyer F, Mittenhuber G, Nies DH, Niesbach-Klösgen U, Patschkowski T, Rückert C, Rupp O, Schneiker S, Schuster SC, Vorhölter FJ, Weber E, Pühler A, Bonas U, Bartels D, Kaiser O. „Insights into genome plasticity and pathogenicity of the plant pathogenic bacterium Xanthomonas campestris pv. vesicatoria revleaed by the complete genome sequence”. Journal of Bacteriology. 2005. Volume 187(21). p 7254-66.
Tamir Ariel D., Navon N, Burdman S. „Identification of Xanthomonas campestris pv. vesicatoria genes induced in its interaction with tomato”. Journal of Bacteriology. 2007. Volume 189(17). P.6359-71.
Weber E, Koebnik R. „Domain structure of HrpE, the Hrp pilus subunit of Xanthomonas campestris pv. vesicatoria”. Journal of Bacteriology. 2005. Volume 187(17). p. 6175-86.
„Xanthomonas campestris pv. vesicatoria.” Kyoto Encyclopedia of Genes and Genomes. Accessed on August 24, 2007.
Tang DJ, He YQ, Feng JX, He BR, Jiang BL, Lu GT, Chen B, Tang JL. „Xanthomonas campestris pv. campestris posesses a single gluconeogenic pathway that is required for virulence.” Journal of Bacteriology. 2005. Volume 187(17). p 6231-7.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. „Kontrolowana synteza sygnału komórka-komórka DSF jest wymagana do tworzenia biofilmu i wirulencji u Xanthomonas campestris”. Environmental Microbiology. 2007. Volume 9(8). p. 2101-9.
Wang L, Tang X, He C. „The bifunctional effector AvrXccC of Xanthomonas campestris pv. campestris requires plasma membrane-anchoring for host recognition.” Molecular Plant Pathology. 2007. Tom 8(4). p 491-501.
Niehaus Karsten. „The Xanthomonas campestris pv. campestris genome project.” Dostęp 20 sierpnia 2007.
Dow JM, Crossman L, Findlay K, He YQ, Feng JX, Tang JL. „Biofilm dispersal in Xanthomonas campestris is controlled by cell-cell signaling and is required for full virulence to plants”. Proceedings of the National Academy of Sciences of the United States of America. 2003. Volume 100(19). p 10995-1000.
„Technologies in the Marketplace.” United States Department of Agriculture, Agricultural Research Service (ARS). Dostęp 21 sierpnia, 2007.
Massomo S, Mortensen C, Mabagala R, Newman M, Hockenhull J. „Biological control of black rot (Xanthomonas campestris pv. campestris) of Cabbage in Tanzania with Bacillus strains”. Journal of Phytopathology. 2004. Volume 152(2). p. 98-105.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. „Controlled synthesis of the DSF cell-cell signal is required for biofilm formation and virulence in Xanthomonas campestris”. Environmental microbiology. 2007. Volume 9(8). p 2101-9.
Ignatov, A., Sechler, A.J., Schuenzel, E., Agarkova, I.V., Vidaver, A.K., Oliver, B., Schaad, N.W. 2007. „Genetic diversity in populations of Xanthomonas campestris pv. campestris in cruciferous weeds in central coastal California”. Phytopathology. 2007. Volume 97. p. 803-812.
Edited by Tammie Chau, student Rachel Larsen
.