Xanthomonas campestris
Una pagina Microbial Biorealm sul genere Xanthomonas campestris
Classificazione
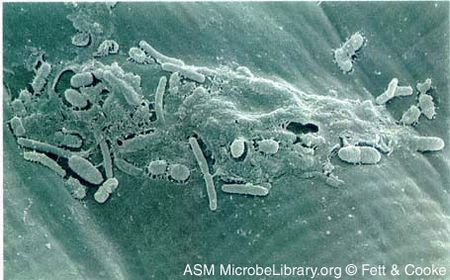
Courtesy of Fett & Cooke, ASM MicrobeLibrary
Tassi di ordine superiore
Batteri
Proteobatteri
Gamma Proteobacteria
Xanthomonadales
Xanthomonadaceae
Xanthomonas
Xanthomonas campestris
Specie
NCBI: Taxonomy
Xanthomonas campestris
Descrizione e significato
Xanthomonas campestris è un bastoncino aerobico, Gram-negativo noto per causare il marciume nero nelle crucifere scurendo i tessuti vascolari. Associato all’ospite, oltre 20 diversi patovari di X. campestris sono stati identificati per la loro patogenicità distintiva su una vasta gamma di piante, comprese le colture e le piante selvatiche. Questo batterio è mesofilo con temperatura ottimale a 25-30 gradi Celsius (77-85 gradi Fahrenheit) e inattivo a temperature inferiori a 10 gradi Celsius (50 gradi Fahrenheit) . X. campestris ha pili di risposta ipersensibile e patogenicità (Hrp) che aiutano a trasferire proteine effettrici per diminuire la difesa dell’ospite e scivolare attraverso l’acqua. Possono vivere in un terreno per oltre un anno e diffondersi attraverso qualsiasi movimento d’acqua, compresa la pioggia, l’irrigazione e l’acqua di superficie. Spruzzare piante sane con fungicidi di rame può ridurre la diffusione dei batteri nel campo. Tuttavia, una volta che la pianta è stata infettata, X. campestris finirà per diffondersi al gambo del seme inibendo la crescita di una prole sana.
Con la fermentazione in coltura pura, X. campestris può produrre un polisaccaride extracellulare noto come gomma xantana che viene prodotto commercialmente come agente stabilizzante utilizzato in molti prodotti di uso quotidiano tra cui condimenti per insalata o dentifricio. X. campestris è un organismo modello per studiare le interazioni tra piante e batteri. A causa del deficit nei raccolti, ulteriori ricerche su questo batterio sono in corso nella speranza di imparare come rendere le piante resistenti a questo patogeno.
Struttura del genoma
Le strutture del genoma di X. campestris contengono variazioni a seconda dei patovari. Tuttavia, i diversi ceppi di X. campestris mostrano caratteristiche simili come i cromosomi circolari, gli elementi genetici mobili e le sequenze di codifica delle proteine. Nel 2002, il genoma completo di X. campestris pv campestris (Xcc) str. ATCC 33913 è stato completato contenendo oltre 5.076.188 nucleotidi che codificano per oltre 4200 proteine codificanti e 61 RNA strutturali. Con oltre 548 sequenze codificanti uniche, X. campestris pv. vesicatoria (Xcv) è composto da un cromosoma circolare di 5,17 Mb, quattro plasmidi e un sistema di secrezione di proteine di tipo III essenziale per la patogenicità. Usando la tecnologia di espressione in vivo basata su Recominbase per colpire il pomodoro, Xcv è stato trovato per avere 61 geni che sono coinvolti nell’interazione tra patogeno e ospite, compreso un trasportatore di virulenza necessario, il gene omologo citH .
Struttura cellulare e metabolismo
X. campestris è un batterio Gram-negativo a forma di bastoncino caratterizzato dalle sue due pareti cellulari e dal pigmento giallo. Ha una struttura filamentosa chiamata risposta ipersensibile e patogenicità (Hrp) pili che è attaccato al sistema di secrezione delle proteine di tipo III implementando la capacità di trasferire le proteine batteriche alla pianta e anche la motilità in acqua .
Questo batterio aerobico esegue una serie di percorsi metabolici che dipendono unicamente dal patogeno. Il sequenziamento dell’intero genoma di Xcv mostra metabolismi di carboidrati che includono: Glicolisi/ Gluconeogenesi, ciclo del citrato (ciclo TCA), via del fosfato pentoso e altro. Xcv ottiene la sua fonte di energia attraverso la fosforilazione ossidativa, la fissazione del carbonio, il metabolismo del metano, dell’azoto e dello zolfo.
X. campestris acquisisce carbonio dall’ospite convertendolo in glucosio attraverso la gluconeogenesi. Ulteriori ricerche hanno dimostrato che nella gluconeogenesi, Xcc contiene solo la via dell’enzima malico-PpsA che è essenziale per la virulenza. Inoltre, questo patogeno vegetale contiene un sistema di secrezione di tipo III (TTSS) che è necessario per attaccare l’ospite. TTSS è importante nella patogenesi perché trasferisce proteine effettrici per abbassare la difesa dell’ospite. Creando biofilm su superfici vegetali, X. campestris esemplifica la comunicazione cellula-cellula attraverso il fattore di segnale diffusibile (DSF).
Possedendo la capacità di fermentare, X. campestris crea un polisaccaride extracellulare, lo xantano, che è prodotto commercialmente e utilizzato in una varietà di prodotti di uso quotidiano come agente stabilizzante. Vedere Applicazione alla biotecnologia per maggiori dettagli.
Ecologia
X. campestris causa grandi perdite in agricoltura a causa del suo habitat nelle piante. Può vivere nel suolo per più di un anno e diffondersi attraverso l’irrigazione aerea e l’acqua di superficie. Questo batterio prospera particolarmente durante i periodi umidi e caldi con temperature ottimali di 25-30 gradi Celsius (77-85 gradi Fahrenheit). X. campestris dipende dall’acqua per la sopravvivenza e il movimento verso il prossimo ospite. A causa della contaminazione durante le operazioni culturali, le piante colpite di solito si presentano nelle stesse file quando vengono coltivate. Vedere patologia per maggiori dettagli.
Patologia

X. campestris può essere individuato dalle lesioni nere che si sviluppano sulle superfici delle piante quando contaminate. L’agente patogeno interagisce prima con l’ospite secernendo una serie di proteine effettrici tra cui la reazione ipersensibile utilizzando il sistema di secrezione di tipo III (TTSS). Questi effettori possono comportarsi in modo avirulento travestendosi per secernere diverse proteine di reazione ipersensibile ed esterne in modo che l’interazione avvenga con le cellule dell’ospite. X. campestris si rivolge quindi al tessuto vascolare causando l’oscuramento e la clorosi marginale della foglia. I batteri si insinuano nella foglia verso gli stomi, gli idatodi e le cellule epidermiche dando inizio a nuove lesioni. L’infezione grave si verifica in una giovane piantina. Poiché la malattia avanza in tutta la pianta, il fusto principale non può formarsi, arrestando lo sviluppo e annerendo le vene. Alla fine, i batteri proliferano in tutto il sistema vascolare e al gambo del seme, causando l’infezione del seme di malattie future.
Apparendo maggiormente durante le stagioni umide, X. campestris possiede pili che permettono un movimento scivoloso attraverso le foglie bagnate. Coprendo un’area colpita in gran numero, una volta che una pianta è malata, l’agente patogeno si diffonde in qualsiasi forma di movimento dell’acqua, compresi gli spruzzi di pioggia, verso un nuovo ospite.
I fattori di virulenza consistono in enzimi litici che attaccano la parete cellulare della pianta, escrezione di proteasi, amilasi, cellulasi e lipasi che aiutano ad abbassare i meccanismi di difesa della pianta. Inoltre, il cluster di geni Rpf è anche cruciale per la patogenesi affinché X. campestris moderi la produzione di questi fattori virulenti.
Applicazione alla biotecnologia
X. campestris fermenta un agente stabilizzante chiamato gomma xantana che è usato in molti prodotti di uso quotidiano. È stato prodotto commercialmente per la prima volta dalla Kelco Company, un’importante azienda farmaceutica. Questo polisaccaride è un ingrediente in prodotti come il condimento francese Kraft, il cibo Weight Watchers, i prodotti Wonder Bread, e altro ancora. Dalla fermentazione dei carboidrati da parte di X. campestris, la caratteristica pseudoplastica e facilmente miscelabile della gomma xantana permette di utilizzarla come addensante aumentando la viscosità di un liquido. Inoltre, la gomma di xantano prolunga i pozzi di petrolio e di gas anche dopo la produzione. Sia pompata nel terreno o utilizzando la sabbiatura ad alta pressione, la miscelazione di acqua e gomma di xantano nei pozzi aiuterà ad addensare il liquido per rilasciare i prodotti grezzi del petrolio e tagliare le rocce nei pozzi di gas e petrolio. La gomma xantana costa 7 dollari per libbra rispetto all’amido di mais che costa 89 centesimi per libbra.
Ricerca attuale
8.1 Controllo biologico con ceppi di Bacillus
Il sequenziamento del genoma viene fatto alla ricerca dei geni essenziali necessari per sviluppare piante resistenti. È stato fatto un esperimento utilizzando ceppi di Bacillus tra cui B. cereus, B. lentimorbus e B. pumilus come rivale del patogeno Xcc nel cavolo. Le prove hanno mostrato qualche speranza di controllo biologico quando il ceppo di Bacillus è stato aggiunto nelle radici.
8.2 Rete di regolazione per la comunicazione cellula-cellula
Studi recenti dimostrano che X. campestris usa il fattore di segnale diffusibile (DSF) per la comunicazione cellula-cellula. Affinché le microcolonie formino biofilm strutturati, la sintesi del DSF è richiesta dal cluster di regolazione del fattore di patogenicità (Rpf). Il cluster Rpf contiene i geni necessari per la patogenesi. Senza la segnalazione critica del DSF, Xcc creerà un biofilm non strutturato di batteri. Sono in corso ulteriori ricerche per capire come viene monitorata la rete di regolazione .
8.3 Variazione genetica nelle crucifere selvatiche
I ricercatori hanno trovato diversità genetica in Xcc sulle crucifere selvatiche. Con le piante crucifere selvatiche più diverse e abbondanti del mondo, sono stati fatti studi in California per trovare qualsiasi differenza nei ceppi genetici di Xcc nelle erbacce selvatiche infette. Sia da aree non coltivate che coltivate, l’Xcc è stato isolato da diverse regioni della California. Usando il polimorfismo di lunghezza del frammento amplificato PCR (AFLP) per identificare la variazione genetica nei ceppi, oltre 72 ceppi sono stati sequenziati per mostrare 7 genotipi unici che erano limitati ai loro rispettivi siti. Le erbacce selvatiche non coltivate vicino alla costa avevano ceppi di Xcc che erano specifici della regione e diversi dalle erbacce coltivate vicino alle aree di produzione.
Riferimento
Averre, Charles W. “Black Rot of Cabbage and Related Crops” Accessed on August 16, 2007.
Ritchie David F, Averre Charles W. “Bacterial Spot of Pepper and Tomato”. North Carolina State University College of Agriculture and Life Sciences. Accesso il 20 agosto 2007.
Weber E, Ojanen-Reuhs T, Huguet E, Hause G, Romantschuk M, Korhonen TK, Bonas U, Koebnik R. “Il pilus Hrp di tipo III-dipendente è richiesto per l’interazione produttiva di Xanthomonas campestris pv. vesicatoria con le piante ospiti di pepe”. Giornale di Batteriologia. 2005. Volume 187(7) p.2458-69.
Kuntz, L. “X is for Xanthan Gum”. Food Product Design. Accesso il 26 agosto 2007.
Vorhölter FJ, Thias T, Meyer F, Bekel T, Kaiser O, Pühler A, Niehaus K. “Il confronto di due genomi di Xanthomonas campestris pv. campestris rivela differenze nella loro composizione genica”. Gazzetta Biotecnologia. 2003. Volume 106(203). p.193-202.
“Xanthomonas campestris pv. campestris str. ATCC 33913, genoma completo”. Biblioteca pubblica di biologia della scienza. 2002. Accesso il 25 agosto 2007.
Thieme F, Koebnik R, Bekel T, Berger C, Boch J, Büttner D, Caldana C, Gaigalat L, Goesmann A, Kay S, Kirchner O, Lanz C, Linke B, McHardy AC, Meyer F, Mittenhuber G, Nies DH, Niesbach-Klösgen U, Patschkowski T, Rückert C, Rupp O, Schneiker S, Schuster SC, Vorhölter FJ, Weber E, Pühler A, Bonas U, Bartels D, Kaiser O. “Approfondimenti sulla plasticità del genoma e la patogenicità del batterio patogeno delle piante Xanthomonas campestris pv. vesicatoria rivleaed dalla sequenza completa del genoma”. Giornale di Batteriologia. 2005. Volume 187(21). p 7254-66.
Tamir Ariel D., Navon N, Burdman S. “Identificazione dei geni di Xanthomonas campestris pv. vesicatoria indotti nella sua interazione con il pomodoro”. Giornale di Batteriologia. 2007. Volume 189(17). P.6359-71.
Weber E, Koebnik R. “Struttura del dominio di HrpE, la subunità Hrp pilus di Xanthomonas campestris pv. vesicatoria”. Giornale di Batteriologia. 2005. Volume 187(17). p. 6175-86.
“Xanthomonas campestris pv. vesicatoria”. Kyoto Encyclopedia of Genes and Genomes. Accesso il 24 agosto 2007.
Tang DJ, He YQ, Feng JX, He BR, Jiang BL, Lu GT, Chen B, Tang JL. “Xanthomonas campestris pv. campestris possiede una singola via gluconeogenica che è richiesta per la virulenza”. Giornale di Batteriologia. 2005. Volume 187(17). p 6231-7.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. “La sintesi controllata del segnale cellula-cellula DSF è richiesta per la formazione del biofilm e la virulenza in Xanthomonas campestris”. Microbiologia ambientale. 2007. Volume 9(8). p. 2101-9.
Wang L, Tang X, He C. “L’effettore bifunzionale AvrXccC di Xanthomonas campestris pv. campestris richiede l’ancoraggio alla membrana del plasma per il riconoscimento dell’ospite”. Patologia vegetale molecolare. 2007. Volume 8(4). p 491-501.
Niehaus Karsten. “Il progetto del genoma di Xanthomonas campestris pv. campestris”. Accesso il 20 agosto 2007.
Dow JM, Crossman L, Findlay K, He YQ, Feng JX, Tang JL. “La dispersione del biofilm in Xanthomonas campestris è controllata dalla segnalazione cellula-cellula ed è necessaria per la piena virulenza alle piante”. Atti dell’Accademia Nazionale delle Scienze degli Stati Uniti d’America. 2003. Volume 100(19). p 10995-1000.
“Tecnologie sul mercato”. Dipartimento dell’Agricoltura degli Stati Uniti, Servizio di Ricerca Agricola (ARS). Acceduto il 21 agosto 2007.
Massomo S, Mortensen C, Mabagala R, Newman M, Hockenhull J. “Controllo biologico del marciume nero (Xanthomonas campestris pv. campestris) del cavolo in Tanzania con ceppi di Bacillus”. Giornale di fitopatologia. 2004. Volume 152(2). p. 98-105.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. “La sintesi controllata del segnale cellula-cellula DSF è richiesta per la formazione di biofilm e la virulenza in Xanthomonas campestris”. Microbiologia ambientale. 2007. Volume 9(8). p 2101-9.
Ignatov, A., Sechler, A.J., Schuenzel, E., Agarkova, I.V., Vidaver, A.K., Oliver, B., Schaad, N.W. 2007. “Diversità genetica nelle popolazioni di Xanthomonas campestris pv. campestris in erbacce crucifere nella California costiera centrale”. Fitopatologia. 2007. Volume 97. p. 803-812.
Redatto da Tammie Chau, studente di Rachel Larsen