Xanthomonas campestris
Une page de biorégime microbien sur le genre Xanthomonas campestris
Classification
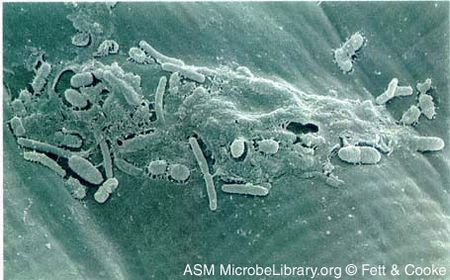
Courtesy of Fett & Cooke, ASM MicrobeLibrary
Taxons d’ordre supérieur
Bactéries
Protéobactéries
Protéobactéries gamma
.
Xanthomonadales
Xanthomonadaceae
Xanthomonas
Xanthomonas campestris
Espèces
NCBI : Taxonomie
Xanthomonas campestris
Description et importance
Xanthomonas campestris est un bâtonnet aérobie à Gram négatif connu pour provoquer la pourriture noire des crucifères en assombrissant les tissus vasculaires. Associé à l’hôte, plus de 20 différents pathovars de X. campestris ont été identifiés par leur pathogénicité distinctive sur une large gamme de plantes, y compris les cultures et les plantes sauvages. Cette bactérie est mésophile avec une température optimale de 25-30 degrés Celsius (77-85 degrés Fahrenheit) et inactive à des températures inférieures à 10 degrés Celsius (50 degrés Fahrenheit). X. campestris a une réponse hypersensible et des pili pathogènes (Hrp) qui aident à transférer des protéines effectrices pour diminuer la défense de l’hôte et glisser dans l’eau. Ils peuvent vivre dans un sol pendant plus d’un an et se propager par tout mouvement d’eau, y compris la pluie, l’irrigation et les eaux de surface. La pulvérisation de fongicides à base de cuivre sur des plantes saines peut réduire la propagation de la bactérie dans le champ. Cependant, une fois que la plante a été infectée, X. campestris finira par se propager à la tige de la graine inhibant la croissance d’une progéniture saine.
Par fermentation en culture pure, X. campestris peut produire un polysaccharide extracellulaire connu sous le nom de gomme xanthane qui est fabriquée commercialement comme agent stabilisant utilisé dans de nombreux produits de la vie courante, y compris la vinaigrette ou le dentifrice . X. campestris est un organisme modèle pour l’étude des interactions entre les plantes et les bactéries. En raison du déficit des cultures, d’autres recherches sur cette bactérie sont en cours dans l’espoir d’apprendre comment rendre les plantes résistantes à ce pathogène.
Structure du génome
Les structures du génome de X. campestris contiennent des variations en fonction des pathovars. Cependant, les différentes souches de X. campestris présentent des caractéristiques similaires comme les chromosomes circulaires, les éléments génétiques mobiles et les séquences codant pour les protéines . En 2002, le génome complet de X. campestris pv campestris (Xcc) str. ATCC 33913 a été achevé, contenant plus de 5 076 188 nucléotides qui codent pour plus de 4 200 protéines codantes et 61 ARN structurels. Avec plus de 548 séquences codantes uniques, X. campestris pv. vesicatoria (Xcv) est composé d’un chromosome circulaire de 5,17 Mb, de quatre plasmides et d’un système de sécrétion de protéines de type III essentiel à la pathogénicité. En utilisant la technologie d’expression in vivo basée sur la recominbase pour cibler la tomate, on a découvert que Xcv possède 61 gènes qui sont impliqués dans l’interaction entre le pathogène et l’hôte, y compris un transporteur de virulence nécessaire, le gène homologue citH .
Structure cellulaire et métabolisme
X. campestris est une bactérie Gram-négative en forme de bâtonnet caractérisée par ses deux parois cellulaires et son pigment jaune. Il a une structure filamenteuse appelée réponse hypersensible et pathogénicité (Hrp) pili qui est attaché à la protéine de type III système de sécrétion mettant en œuvre la capacité de transférer des protéines bactériennes à la plante et aussi la motilité dans l’eau .
Cette bactérie aérobie effectue un certain nombre de voies métaboliques qui dépendent uniquement du pathovar. Le séquençage du génome entier de Xcv montre des métabolismes de glucides qui comprennent : Glycolyse/gluconéogenèse, cycle du citrate (cycle TCA), voie du pentose phosphate, et plus encore. Xcv gagne sa source d’énergie par la phosphorylation oxydative, la fixation du carbone, le méthane, l’azote et le métabolisme du soufre .
X. campestris acquiert du carbone de l’hôte en le convertissant en glucose par la gluconéogenèse. D’autres recherches ont montré que dans la gluconéogenèse, Xcc ne contient que la voie de l’enzyme malique-PpsA qui est essentielle pour la virulence . En outre, ce phytopathogène contient un système de sécrétion de type III (TTSS) qui est nécessaire pour attaquer l’hôte. Le TTSS est important dans la pathogenèse car il transfère des protéines effectrices afin d’abaisser la défense de l’hôte. Créant un biofilm sur les surfaces végétales, X. campestris exemplifie la communication cellule-cellule par le biais du facteur de signal diffusible (DSF) .
Possédant la capacité de fermenter, X. campestris crée un polysaccharide extracellulaire, le xanthane, qui est produit commercialement et utilisé dans une variété de produits quotidiens comme agent stabilisant . Voir Application à la biotechnologie pour plus de détails.
Ecologie
X. campestris cause de grandes pertes en agriculture en raison de leur habitat dans les plantes. Il peut vivre dans le sol pendant plus d’un an et se propager par l’irrigation aérienne et les eaux de surface . Cette bactérie se développe particulièrement par temps humide et chaud avec des températures optimales de 25-30 degrés Celsius (77-85 degrés Fahrenheit). X. campestris dépend de l’eau pour survivre et se déplacer vers le prochain hôte. En raison de la contamination lors des opérations culturales, les plantes affectées se trouvent généralement dans les mêmes rangées lorsqu’elles sont cultivées . Voir pathologie pour plus de détails.
Pathologie

X. campestris peut être repéré par les lésions noires qui se développent sur les surfaces des plantes lorsqu’elles sont contaminées. L’agent pathogène interagit d’abord avec l’hôte en sécrétant un ensemble de protéines effectrices, notamment la réaction hypersensible utilisant le système de sécrétion de type III (TTSS) . Ces effecteurs peuvent se comporter de manière avirulente en se déguisant pour sécréter plusieurs protéines de réaction hypersensible et des protéines externes afin de permettre l’interaction avec les cellules de l’hôte. X. campestris cible ensuite les tissus vasculaires, provoquant un assombrissement et une chlorose marginale des feuilles. La bactérie s’infiltre dans la feuille vers les stomates, les hydathodes et les cellules épidermiques, provoquant de nouvelles lésions. Une infection sévère se produit dans un jeune plant. Comme la maladie progresse dans toute la plante, la tige principale ne peut pas se former, ce qui retarde le développement et noircit les nervures. Finalement, la bactérie prolifère dans tout le système vasculaire et jusqu’à la tige de la graine, provoquant l’infection de la graine de futures maladies .
Apparaissant davantage pendant les saisons humides, X. campestris possède des pili qui s’accommodent d’un mouvement glissant à travers les feuilles humides. Couvrant une zone affectée en de nombreux nombres, une fois qu’une plante est malade, le pathogène se répandra dans toute forme de mouvement d’eau, y compris les éclaboussures de gouttes de pluie, vers un nouvel hôte .
Les facteurs de virulence consistent en des enzymes lytiques qui attaquent la paroi cellulaire de la plante, l’excrétion de protéases, amylases, cellulases et lipases qui aident à diminuer les mécanismes de défense de la plante . En outre, le cluster de gènes Rpf est également crucial pour la pathogenèse afin que X. campestris modère la production de ces facteurs virulents .
Application à la biotechnologie
X. campestris fermente un agent stabilisant appelé gomme xanthane qui est utilisé dans de nombreux produits de la vie quotidienne. Elle a d’abord été produite commercialement par la société Kelco, une grande entreprise pharmaceutique. Ce polysaccharide est un ingrédient de produits comme la vinaigrette française Kraft, les aliments Weight Watchers, les produits Wonder Bread, etc. Issue de la fermentation des hydrates de carbone par X. campestris, la caractéristique pseudoplastique de la gomme xanthane, qui se mélange facilement, lui permet d’être utilisée comme épaississant en augmentant la viscosité d’un liquide . En outre, la gomme xanthane permet de prolonger les puits de pétrole et de gaz, même après leur production. Que ce soit par pompage dans le sol ou par sablage à haute pression, le mélange d’eau et de gomme de xanthane dans les puits aidera à épaissir le liquide pour libérer les produits bruts du pétrole et à couper les roches dans les puits de gaz et de pétrole. La gomme xanthane coûte 7 $ la livre, comparativement à l’amidon de maïs qui coûte 89 cents la livre .
Recherche actuelle
8.1 Contrôle biologique avec des souches de Bacillus
Le séquençage du génome est fait à la recherche des gènes essentiels nécessaires afin de développer des plantes résistantes. Une expérience a été faite en utilisant des souches de Bacillus comprenant B. cereus, B. lentimorbus, et B. pumilus comme rival du pathogène Xcc dans le chou. Des preuves ont montré un certain espoir de contrôle biologique lorsque la souche de Bacillus a été ajoutée dans les racines .
8.2 Réseau de régulation pour la communication cellule-cellule
Des études récentes démontrent que X. campestris utilise le facteur de signal diffusible (DSF) pour la communication cellule-cellule. Pour que les microcolonies forment un biofilm structuré, la synthèse du DSF est nécessaire à partir du cluster de régulation du facteur de pathogénicité (Rpf). Le cluster Rpf contient les gènes nécessaires à la pathogenèse. Sans la signalisation critique du DSF, Xcc créera un biofilm non structuré de bactéries. Des recherches supplémentaires sont menées pour comprendre comment le réseau de régulation est surveillé .
8.3 Variation génétique dans les crucifères sauvages
Les chercheurs ont trouvé une diversité génétique dans Xcc sur les crucifères sauvages. Avec les plantes crucifères sauvages les plus diverses et les plus abondantes au monde, des études ont été faites en Californie pour trouver toute différence dans les souches génétiques sur Xcc dans les mauvaises herbes sauvages infectées. Dans les zones cultivées et non cultivées, Xcc a été isolé dans différentes régions de Californie. En utilisant la PCR (Amplified fragment length polymorphism) pour identifier la variation génétique des souches, plus de 72 souches ont été séquencées pour montrer 7 génotypes uniques qui étaient limités à leurs sites respectifs. Les mauvaises herbes sauvages non cultivées près de la côte présentaient des souches de Xcc spécifiques à la région et différentes des mauvaises herbes cultivées près des zones de cultures produites.
Référence
Averre, Charles W. « Black Rot of Cabbage and Related Crops » Consulté le 16 août 2007.
Ritchie David F, Averre Charles W. « Bacterial Spot of Pepper and Tomato ». Collège des sciences de l’agriculture et de la vie de l’université d’État de Caroline du Nord. Consulté le 20 août 2007.
Weber E, Ojanen-Reuhs T, Huguet E, Hause G, Romantschuk M, Korhonen TK, Bonas U, Koebnik R. « The type III-dependent Hrp pilus is required for productive interaction of Xanthomonas campestris pv. vesicatoria with pepper host plants ». Journal of Bacteriology. 2005. Volume 187(7) p.2458-69.
Kuntz, L. « X is for Xanthan Gum ». Food Product Design. Consulté le 26 août 2007.
Vorhölter FJ, Thias T, Meyer F, Bekel T, Kaiser O, Pühler A, Niehaus K. « Comparison of two Xanthomonas campestris pv. campestris genomes revealed differences in their gene composition ». Journal Biotechnology. 2003. Volume 106(203). p.193-202.
« Xanthomonas campestris pv. campestris str. ATCC 33913, génome complet ». Bibliothèque publique de biologie scientifique. 2002. Consulté le 25 août 2007.
Thieme F, Koebnik R, Bekel T, Berger C, Boch J, Büttner D, Caldana C, Gaigalat L, Goesmann A, Kay S, Kirchner O, Lanz C, Linke B, McHardy AC, Meyer F, Mittenhuber G, Nies DH, Niesbach-Klösgen U, Patschkowski T, Rückert C, Rupp O, Schneiker S, Schuster SC, Vorhölter FJ, Weber E, Pühler A, Bonas U, Bartels D, Kaiser O. « Insights into genome plasticity and pathogenicity of the plant pathogenic bacterium Xanthomonas campestris pv. vesicatoria revleaed by the complete genome sequence ». Journal of Bacteriology. 2005. Volume 187(21). p 7254-66.
Tamir Ariel D., Navon N, Burdman S. « Identification des gènes de Xanthomonas campestris pv. vesicatoria induits dans son interaction avec la tomate ». Journal of Bacteriology. 2007. Volume 189(17). P.6359-71.
Weber E, Koebnik R. « Domain structure of HrpE, the Hrp pilus subunit of Xanthomonas campestris pv. vesicatoria ». Journal of Bacteriology. 2005. Volume 187(17). p. 6175-86.
« Xanthomonas campestris pv. vesicatoria ». Encyclopédie des gènes et des génomes de Kyoto. Consulté le 24 août 2007.
Tang DJ, He YQ, Feng JX, He BR, Jiang BL, Lu GT, Chen B, Tang JL. « Xanthomonas campestris pv. campestris possède une seule voie gluconéogénique qui est nécessaire pour la virulence ». Journal of Bacteriology. 2005. Volume 187(17). p 6231-7.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. « La synthèse contrôlée du signal cellulaire DSF est nécessaire à la formation du biofilm et à la virulence de Xanthomonas campestris ». Environmental Microbiology. 2007. Volume 9(8). p. 2101-9.
Wang L, Tang X, He C. « L’effecteur bifonctionnel AvrXccC de Xanthomonas campestris pv. campestris nécessite un ancrage à la membrane plasmique pour la reconnaissance de l’hôte ». Molecular Plant Pathology. 2007. Volume 8(4). p 491-501.
Niehaus Karsten. « Le projet du génome de Xanthomonas campestris pv. campestris ». Consulté le 20 août 2007.
Dow JM, Crossman L, Findlay K, He YQ, Feng JX, Tang JL. « La dispersion du biofilm chez Xanthomonas campestris est contrôlée par la signalisation cellulaire et est nécessaire pour la virulence complète aux plantes ». Proceedings of the National Academy of Sciences of the United States of America. 2003. Volume 100(19). p 10995-1000.
« Les technologies sur le marché ». Département de l’agriculture des États-Unis, Service de recherche agricole (ARS). Consulté le 21 août 2007.
Massomo S, Mortensen C, Mabagala R, Newman M, Hockenhull J. « Lutte biologique contre la pourriture noire (Xanthomonas campestris pv. campestris) du chou en Tanzanie avec des souches de Bacillus ». Journal of Phytopathologie. 2004. Volume 152(2). p. 98-105.
Torres PS, Malamud F, Rigano LA, Russo DM, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM, Vojnov AA. « La synthèse contrôlée du signal cellulaire DSF est nécessaire à la formation du biofilm et à la virulence de Xanthomonas campestris ». Environmental microbiology. 2007. Volume 9(8). p 2101-9.
Ignatov, A., Sechler, A.J., Schuenzel, E., Agarkova, I.V., Vidaver, A.K., Oliver, B., Schaad, N.W. 2007. « Diversité génétique dans les populations de Xanthomonas campestris pv. campestris dans les crucifères de la côte centrale de la Californie ». Phytopathology. 2007. Volume 97. p. 803-812.
Éditée par Tammie Chau, étudiante de Rachel Larsen
.