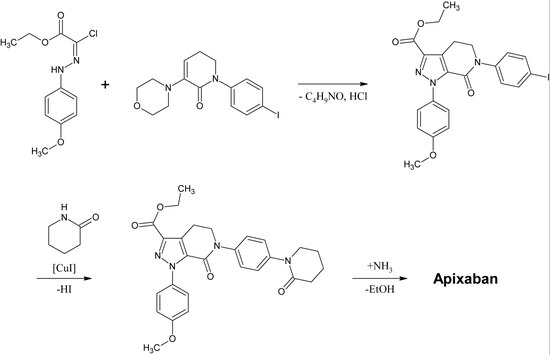
Scoperta e sviluppo di inibitori diretti di Xa
Fattore Xa: Struttura e siti di legameModifica

I fattori IIa, Xa, VIIa, IXa e XIa sono tutti enzimi proteolitici che hanno un ruolo specifico nella cascata della coagulazione. Il fattore Xa (FXa) è il più promettente grazie alla sua posizione all’intersezione della via intrinseca ed estrinseca, oltre a generare circa 1000 molecole di trombina per ogni molecola Xa, il che si traduce in un potente effetto anticoagulante. FXa è generato da FX mediante scissione di un peptide di attivazione di 52 aminoacidi, poiché la “a” in fattore Xa significa attivato. FXa consiste in un dominio catalitico di 254 aminoacidi ed è anche legato a una catena leggera di 142 aminoacidi. La catena contiene sia il dominio GLA che due domini del fattore di crescita epidermico (EGF like domains).
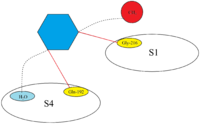
Il sito attivo di FXa è strutturato per catalizzare la scissione di substrati fisiologici e scinde PhePheAsnProArg-ThrPhe e TyrIleAspGlyArg-IleVal nella protrombina. FXa ha quattro cosiddette tasche che sono obiettivi per i substrati da legare al fattore Xa. Queste tasche sono allineate da diversi amminoacidi e gli inibitori Xa mirano a queste tasche quando si legano al fattore Xa. Le due tasche più rilevanti per quanto riguarda l’affinità e la selettività per gli inibitori Xa sono S1 e S4.
S1: La tasca S1 è una tasca idrofoba e contiene un residuo di acido aspartico (Asp-189) che può servire come sito di riconoscimento per un gruppo basico. FXa ha uno spazio residuo nella tasca S1 ed è rivestito dai residui Tyr-228, Asp-189 e Ser-195.
S2: La tasca S2 è una tasca piccola e poco profonda. Si fonde con la tasca S4 e ha spazio per piccoli aminoacidi. Tyr-99 sembra bloccare l’accesso a questa tasca, quindi questa tasca non è così importante come S1 e S4.
S3: La tasca S3 si trova sul bordo della tasca S1 ed è piatta ed esposta al solvente. Questa tasca non è importante come S1 e S4.
S4: La tasca S4 è di natura idrofoba e il pavimento della tasca è formato dal residuo Trp-215. I residui Phe-174 e Tyr-99 di FXa si uniscono a Trp-215 per formare una scatola aromatica che è in grado di legare frammenti alifatici, aromatici e con carica positiva. A causa del legame con entità caricate positivamente, può essere descritto come un foro cationico.
Struttura chimica e proprietà degli inibitori diretti di XaModifica
| Rivaroxaban | Apixaban | Edoxaban | |
|---|---|---|---|
| MW (g/mol) | 436 | 460 | 548 |
| Formula molecolare formula | C19H18ClN3O5S | C25H25N5O4 | C24H30ClN7O4S |
| forma | L | L | L |
| Ki | 0.4 nM | 0,08 nM | 0.561 nM |
| IC50 | 0.7 nM | N/A | N/A |
| Biodisponibilità orale (%) | 66-100 (dose-dipendente) | 50 | 62 |

Legame degli inibitori dello Xa al fattore XaEdit
Gli inibitori dello Xa si legano tutti in una cosiddetta forma a L nel sito attivo del fattore Xa. I componenti chiave del fattore Xa sono i siti di legame S1 e S4. È stato notato per la prima volta che i composti naturali, antistasina e TAP, che possiedono componenti altamente polari e quindi carichi, si legano al bersaglio con una certa specificità. Ecco perché sono stati progettati nuovi farmaci con gruppi caricati positivamente, ma questi hanno portato a una scarsa biodisponibilità. Gli inibitori Xa attualmente in commercio contengono quindi un anello aromatico con varie società attaccate per diverse interazioni con i siti di legame S1 e S4. Questo assicura anche una buona biodisponibilità, oltre a mantenere una solida forza di legame. Gli inibitori Xa attualmente sul mercato, quindi si basano su legami idrofobici e idrogeno invece di interazioni altamente polari.
Antistasin binding to factor XaEdit
Antistasin contiene un N- e un dominio C-terminale che sono simili nelle loro sequenze di aminoacidi con ~ 40% di identità e ~ 56% di omologia. Ognuno di essi contiene una breve struttura β-sheet e 5 legami disolfuro. Solo il dominio N-terminale è necessario per inibire Xa mentre il dominio C-terminale non contribuisce alle proprietà inibitorie a causa delle differenze nella struttura tridimensionale, anche se il dominio C-terminale ha un modello fortemente analogo al sito attivo effettivo.
L’interazione di antistasina con FXa coinvolge sia il sito attivo che la superficie inattiva di FXa. Il sito reattivo di antistasina formato da Arg-34 e Val-35 nel dominio N-terminale si adatta al sito di legame di FXa, molto probabilmente la tasca S1. Allo stesso tempo, Glu-15 situato al di fuori del sito reattivo di antistasina si adatta ai residui caricati positivamente sulla superficie di FXa. Il legame multiplo è termodinamicamente vantaggioso e porta a un’inibizione sub-nanomolare (Ki = 0,3-0,6 nM).
DX-9065a si lega al fattore XaEdit
DX-9065a, la prima piccola molecola diretta Xa-inibitore, è un derivato amidinoarilico con un peso molecolare di 571,07g/mol. Il suo gruppo amidinonaphtalene caricato positivamente forma un ponte di sale con il residuo Asp-189 nella tasca S1 di FXa. L’anello pirrolidinico si inserisce tra Tyr-99, Phe-174 e Trp-215 nella tasca S4 di FXa.
A differenza dei vecchi farmaci, per esempio l’eparina, DX-9065a è selettivo per FXa rispetto alla trombina anche se FXa e trombina sono simili nella loro struttura. Ciò è causato da una differenza nel residuo aminoacidico nella posizione 192 dell’omologo. Mentre FXa ha un residuo di glutammina in quella posizione, la trombina ha un acido glutammico che causa una repulsione elettrostatica con il gruppo carbossilico di DX-9065a. Inoltre, un ponte salino tra il Glu-97 della trombina e il gruppo amidina fissato nell’anello pirrolidinico di DX-9065a riduce la flessibilità della molecola DX-9065a, che ora non può ruotare abbastanza per evitare lo scontro elettrostatico. Ecco perché il valore IC50 per la trombina è >1000µM mentre il valore IC50 per FXa è 0,16µM.

Rivaroxaban si lega al fattore XaEdit
Rivaroxaban si lega a FXa attraverso due legami a idrogeno all’aminoacido Gly-219. Questi due legami a idrogeno hanno un ruolo importante nel dirigere il farmaco nei sottositi S1 e S4 di FXa. Il primo legame a idrogeno è una forte interazione che proviene dall’ossigeno carbonilico del nucleo ossazolidinone del rivaroxaban. Il secondo legame a idrogeno è un’interazione più debole e proviene dal gruppo amminico della parte carbossilica del clorotiofene.
Questi due legami a idrogeno fanno sì che il farmaco formi una forma a L e si inserisca nelle tasche S1 e S4. Gli aminoacidi residui Phe-174, Tyr-99, e Trp-215 formano uno stretto canale idrofobico che è la tasca di legame S4. La parte di morfolone di rivaroxaban è “a sandwich” tra gli aminoacidi Tyr-99 e Phe-174 e l’anello arilico di rivaroxaban è orientato perpendicolarmente attraverso Trp-215. Il gruppo carbonilico del morfolone non ha un’interazione diretta con la spina dorsale del FXa, invece, contribuisce ad una planarizzazione dell’anello del morfolone e quindi supporta il rivaroxaban ad essere inserito tra i due aminoacidi.
L’interazione tra il sostituente del cloro della parte tiofenica e l’anello aromatico di Tyr-228, che si trova nella parte inferiore della S1, è molto importante per il fatto che ovvia alla necessità di gruppi fortemente basici per un’alta affinità per FXa. Questo permette al rivaroxaban, che non è basico, di ottenere una buona biodisponibilità e potenza orale.
Apixaban si lega al fattore XaEdit
Apixaban mostra una modalità di legame simile a rivaroxaban e forma uno stretto complesso inibitore-enzima quando è collegato a FXa. Il gruppo p-metossi di apixaban si collega alla tasca S1 di FXa ma non sembra avere alcuna interazione con i residui in questa regione di FXa. L’atomo di azoto N-2 del pirazolo di apixaban interagisce con Gln-192 e l’ossigeno carbonile interagisce con Gly-216. Il gruppo fenil-lattamico di apixaban è posizionato tra Tyr-99 e Phe-174 e grazie al suo orientamento, è in grado di interagire con Trp-215 della tasca S4. Il gruppo di ossigeno carbonile della moiety del lattame interagisce con una molecola d’acqua e non sembra interagire con alcun residuo della tasca S4.

Relazione struttura-attività (SAR)Edit
Una parte importante della progettazione di un composto, che è un inibitore ideale per un certo obiettivo, è capire la sequenza di aminoacidi del sito bersaglio per il composto da legare. Modellare sia la protrombina che FXa permette di dedurre la differenza e identificare gli amminoacidi in ogni sito di legame. In fondo alla tasca S1 su FXa l’amminoacido di legame è Asp-189 a cui possono legarsi le amidine. Dopo aver radiografato il sito di legame del FXa, è stato rivelato che la tasca S1 ha una forma planare, il che significa che un gruppo amidinoarilico piatto dovrebbe legarsi ad essa senza ostacoli sterici.
I moderni inibitori diretti del Xa sono molecole a forma di L le cui estremità si inseriscono perfettamente nelle tasche S1 e S4. Il lato lungo della forma a L deve conformarsi a un tunnel altamente specifico all’interno del sito attivo del bersaglio. Per ottenere ciò, questa parte delle molecole è progettata per avere poche interazioni formali con FXa in quella regione. Poiché non c’è alcun legame specifico, l’adattamento di questi agenti tra le tasche di FXa aumenta la specificità totale dei farmaci alla molecola FXa. L’interazione tra la tasca S1 di FXa e l’inibitore può essere sia ionica che non ionica, il che è importante perché permette di regolare il design della moiety per aumentare la biodisponibilità orale. I composti progettati in precedenza erano molecole cariche che non vengono assorbite bene nel tratto gastrointestinale e quindi non raggiungevano alte concentrazioni nel siero. I nuovi farmaci hanno una migliore biodisponibilità perché non sono carichi e hanno un’interazione non ionica con la tasca S1.
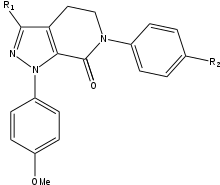
Rivaroxaban
Durante lo sviluppo SAR del rivaroxaban, i ricercatori si sono resi conto che l’aggiunta di un gruppo 5-clorotiofene-2-carbossamide al nucleo dell’oxazolidonina poteva aumentare di 200 volte la potenza, che in precedenza era stata troppo debole per l’uso medico. Oltre a questa scoperta, è stata confermata una chiara preferenza per la configurazione (S). Questo composto aveva un promettente profilo farmacocinetico e non conteneva un gruppo amidino altamente basico, ma che era stato precedentemente considerato importante per l’interazione con la tasca S1. Questi risultati hanno portato ad ampie ricerche SAR (relazione struttura-attività). Durante i test SAR, R1 è stato definito come il gruppo più importante per la potenza. Il pirrolidinone è stato il primo gruppo funzionale R1 ad aumentare significativamente la potenza, ma ulteriori ricerche hanno rivelato una potenza ancora maggiore con un gruppo morfolinone. I gruppi R2 e R3 avevano idrogeno o fluoro attaccati ed è stato rapidamente valutato che avere idrogeno ha portato alla massima potenza. I gruppi R2 e R3 sono stati poi sostituiti con vari gruppi, che erano tutti meno potenti dell’idrogeno, quindi l’idrogeno era il risultato finale. Poiché la moiety di clorotiofene aveva una solubilità in acqua inadeguata, si è tentato di sostituirla con un altro gruppo, ma senza successo. La frazione di clorotiofene si lega a Tyr-228 sul fondo della tasca S1, rendendola un fattore chiave per quanto riguarda il legame con FXa. Rivaroxaban ha sia un’alta affinità che una buona biodisponibilità.
Apixaban
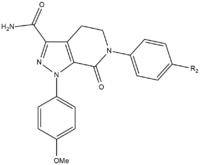
Durante lo sviluppo SAR di apixaban c’erano tre gruppi che dovevano essere testati per raggiungere la massima potenza e biodisponibilità. Il primo gruppo da testare era il sito non attivo in quanto deve essere stabilizzato prima dei test SAR sul gruppo p-metossifenile (moiety di legame S1). Ci sono diversi gruppi che aumentano la potenza del composto, soprattutto ammidi, ammine e tetrazoli ma anche gruppi metilsulfonil e trifluorometil. Di questi gruppi, la carbossamide ha il maggior legame e aveva un’attività di coagulazione simile a quella dei composti.
Nei test sui cani, questo composto con un gruppo carbossamide chiamato 13F, ha mostrato un ottimo profilo farmacocinetico, una bassa clearance e un’adeguata emivita e volume di distribuzione. A causa del successo nella ricerca di un gruppo stabilizzante, la ricerca SAR per la moiety legante S1 (p-metossifenile) è stata interrotta. Nel gruppo legante S4, gli analoghi N-metilacetilici e lattamici hanno dimostrato di avere un’affinità di legame molto alta per FXa, hanno mostrato grande coagulazione e selettività rispetto ad altre proteasi. L’orientamento si è rivelato importante in quanto l’N-metilacetile, rispetto all’acetamide, aveva una capacità di legame 300 volte inferiore a FXa a causa della planarità sfavorevole vicino al sito di legame della regione S4.
SynthesisEdit
RivaroxabanEdit
Rivaroxaban appartiene chimicamente al gruppo dei n-aryloxazolidinones. Altri farmaci di quel gruppo sono il linezolid e il tedizolid, entrambi antibiotici. Una sintesi di n-aryloxazolidinones a partire da un etil(2,3-diidrossipropil)-carbamato protetto da O-silil è stata pubblicata nel 2016. In una reazione one-pot, il carbammato ciclicamente si trasforma in un anello 2-oxazolidone in condizioni leggermente basiche, mentre simultaneamente l’azoto dell’oxazolidone viene arillizzato mediante catalizzazione con rame. Per il rivaroxaban in particolare, il 3-morfolinone sostituisce lo iodio in posizione p dell’anello benzenico mediante catalizzazione con rame. In seguito, il gruppo di protezione sililico viene rimosso e l’alcool risultante viene sostituito da un gruppo amminico che viene poi acilato nell’ultimo passaggio.
Una preparazione industriale di rivaroxaban è stata registrata come brevetto da Bayer Healthcare nel 2005. Parte da N-(4-aminofenolo)-morfolone che viene alchilato da un derivato dell’ossido di propilene che contiene anche un’ammina primaria coinvolta in un gruppo di protezione ftalimmide. Successivamente, un equivalente del fosgene viene aggiunto per formare l’anello 2-oxazolidone e la ftalimmide viene rimossa. L’ammina libera può ora essere acilata, il che porta al rivaroxaban.
Tuttavia, secondo il brevetto, la sintesi presenta “vari svantaggi nella gestione della reazione che ha effetti particolarmente sfavorevoli per la preparazione”. Il brevetto spiega anche un’altra sintesi a partire da un derivato del clorotiofene che sarebbe più adatto al processo industriale, ma sottolinea che i solventi o reagenti tossici devono essere rimossi dal prodotto finale. Pertanto, questo modo non è un’alternativa.
Varie altre vie di sintesi del rivaroxaban sono state descritte.
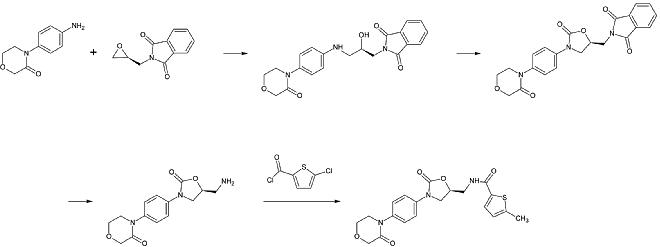
1a fase: Alchilazione dell’ammina aromatica primaria
Secondo passo: Formazione dell’anello 2-oxazolinidone, utilizzando un equivalente del fosgene
3° passo: Rimozione del gruppo di protezione della ftalimmide
4° passo: Acilazione dell’ammina primaria
ApixabanEdit
La prima sintesi completa di apixaban è stata pubblicata nel 2007. Il passo chiave di questa reazione è una (3+2) cicladdizione di un derivato p-metossifenilcloroidrazon e un derivato p-iodofenil-morfolina-diidropiridina. Dopo la successiva eliminazione dell’HCl e della morfolina, lo iodio viene sostituito dal 2-piperidinone mediante catalizzazione con rame e l’etil-estere viene convertito in un’ammide (aminolisi). Questa reazione è stata registrata come brevetto nel 2009.