Withaferin A: potencjalny środek terapeutyczny przeciwko infekcji COVID-19
Nowa choroba koronawirusowa 2019 (COVID-19) szybko rozprzestrzeniła się na całym świecie, odkąd po raz pierwszy zgłoszono ją w grudniu 2019 r. w obrębie Wuhan w Chinach jako zapalenie płuc o nieznanej etiologii . Ciężki ostry zespół oddechowy coronavirus-2 (SARS-CoV-2), określany przez Światową Organizację Zdrowia (WHO), stanowi trzecią epidemię na dużą skalę związaną z koronawirusami . Chociaż choroba została po raz pierwszy zgłoszona w Chinach, retrospektywne badanie znalazło następnie dowody na to, że SARS-CoV-2 rozprzestrzeniał się we Francji 4 dni przed pierwszym zgłoszeniem w Wuhan w Chinach i 1 miesiąc przed pierwszym oficjalnym przypadkiem w tym kraju. Od czasu pierwszego odkrycia SARS-CoV-2 rozprzestrzenił się na całym świecie, zarażając ponad 11,5 miliona osób i doprowadzając do śmierci ponad 530 000 osób (stan na 6 lipca 2020 r.). Ciężkość choroby waha się od bezobjawowego stanu chorobowego do pacjentów wykazujących zespół ostrej niewydolności oddechowej (ARDS), co wymaga krytycznej interwencji medycznej, aby spróbować zapobiec śmierci pacjenta. Następnie odkryto, że enzym konwertujący angiotensynę 2 (ACE2) jest funkcjonalnym receptorem dla białka spike (S-) wirusa SARS-CoV-2, umożliwiając mu wnikanie do komórek. ACE2 jest silnym negatywnym regulatorem układu renina angiotensyna (RAS), który jest krytyczny dla utrzymania homeostazy RAS.
Gen ACE2 składa się z 805 aminokwasów i jest integralną glikoproteiną błonową typu I. ACE2 degraduje angiotensynę (Ang)-II, silny wazokonstryktor (który jest również prozapalny i promuje włóknienie), i przekształca ją w Ang (1-7) . Ang (1-7) jest wazodylatatorem, który również hamuje proliferację i apoptozę. Oprócz ogólnoustrojowego wpływu na regulację ciśnienia krwi, ACE2 ma lokalne działanie regulacyjne w zmianach patologicznych kilku narządów, w tym serca, nerek i płuc. ACE2 ulega wysokiej ekspresji w komórkach pęcherzyków płucnych, stanowiąc główne miejsce wnikania wirusa do ludzkiego gospodarza. Oprócz ekspresji ACE2 w komórkach pęcherzyków płucnych, ulega ona również ekspresji w różnych tkankach, w tym: układ naczyniowy (komórki śródbłonka, migrujące komórki angiogenne i komórki mięśni gładkich naczyń), serce (kardiofibroblasty, kardiomiocyty, komórki śródbłonka, perycyty i komórki tłuszczowe nasierdzia) i nerki (komórki śródbłonka kłębuszków nerkowych, podocyty i komórki nabłonka kanalików proksymalnych), wątroba (cholangiocyty i hepatocyty), siatkówka (komórki nabłonka barwnikowego, komórki fotoreceptorowe pręcikowe i stożkowe oraz komórki glejowe Müllera), enterocyty jelit, narządy obwodowe ośrodkowego układu nerwowego i górne drogi oddechowe (komórki nabłonka gruczołowego i rzęskowego).
Istnieją dwie podjednostki białka S SARS-CoV-2: podjednostka S1 ma domenę wiążącą receptor, która łączy się z receptorem komórki gospodarza ACE2, a podjednostka S2 jest zaangażowana w regulację fuzji między błoną wirusową a błoną gospodarza. Stwierdzono, że SARS-CoV-2 ma dziesięciokrotnie wyższe powinowactwo do ACE2 w porównaniu do SARS-CoV, co jest zgodne z wyższą skutecznością infekcji SARS-CoV-2. Chociaż obecnie nie znaleziono lekarstwa, prowadzone są liczne badania kliniczne w celu określenia najskuteczniejszego schematu leczenia COVID-19, a obszerna lista potencjalnych terapii została szczegółowo opisana w przeglądzie autorstwa Gosain i in. Obecnie postępowanie z pacjentem obejmuje leczenie wspomagające i środki zapobiegające dalszemu rozprzestrzenianiu się wirusa. Pomimo różnic w charakterystyce populacji pacjentów między Europą a Chinami, dwoma głównymi wyznacznikami ryzyka śmiertelności pacjentów, które stwierdzono w obu grupach, są wiek i obecność podstawowych chorób współistniejących. Jednym z takich podstawowych schorzeń związanych ze wzrostem śmiertelności pacjentów z COVID-19 jest obecność raka .
Chorzy na raka i epidemia COVID-19
Dzięki ich potencjalnie obniżonej odporności, właściwe leczenie pacjentów z rakiem jest rzeczywistym i poważnym problemem, z którym borykają się onkolodzy, niezależnie od tego, czy pacjent doświadcza zakażenia SARS-CoV-2 . Dane z czterech punktów zapalnych SARS-CoV-2 (Stany Zjednoczone, Włochy, Hiszpania i Chiny) wykazały, że pacjenci z nowotworami zakażeni nowym koronawirusem mają znacznie zwiększone ryzyko przyjęcia na oddział intensywnej terapii (ICU) i/lub wymagający wentylacji mechanicznej, jak również wzrost śmiertelności pacjentów. W retrospektywnym badaniu stwierdzono, że śmiertelność wśród pacjentów z nowotworami w Chinach zakażonych COVID-19 wynosiła około 28%, w porównaniu z ogólnym wskaźnikiem śmiertelności objawowej wynoszącym 1,4% lub surowym wskaźnikiem śmiertelności wynoszącym 4,5% w Chinach. Być może nie jest zaskoczeniem, że śmiertelność wśród pacjentów z rakiem płuc zakażonych SARS-CoV-2 jest dość ponura, a nowojorskie badanie kohortowe wykazało 55% śmiertelność. Pacjenci chorzy na raka i ich onkolodzy stoją obecnie przed dylematem, czy pacjent powinien rozpocząć lub kontynuować terapię swojego pierwotnego stanu chorobowego ze względu na związane z tym ryzyko zakażenia SARS-CoV-2 i zmniejszenie zasobów dostępnych dla pracowników służby zdrowia. Informacje na temat szczególnej etiologii nowotworu są skąpe w kilku badaniach dotyczących SARS-CoV-2. Jednak rak płuc, piersi, przewodu pokarmowego i nowotwory hematologiczne (np. chłoniak) zostały zgłoszone w ramach badań kohortowych COVID-19 w Stanach Zjednoczonych, Włoszech i Chinach. Ponadto, w badaniach tych odnotowano pacjentów z rakiem szyjki macicy i pacjentów z innymi nieokreślonymi ginekologicznymi nowotworami złośliwymi .
Chociaż wybrane źródła literaturowe zapewniają wgląd w wystawiane paradygmaty onkologiczne, już niewielka oceniana populacja pacjentów zmniejsza się jeszcze bardziej, gdy jest stratyfikowana przez typowanie onkologiczne. Stanowi to istotne ograniczenie dla oceny ryzyka śmiertelności i opracowania wytycznych postępowania u chorych na raka COVID-19-dodatniego. Podobnie, bardzo niewiele wiadomo na temat zakażenia COVID-19 u chorych na raka jajnika. W chwili pisania tego artykułu w PubMed znajdują się 22 artykuły na ten temat, z czego 20 z nich omawia potencjalne zmiany lub wyzwania, przed którymi stoją kliniki onkologiczne, aby lepiej służyć chorym na raka jajnika. Pozostałe dwa artykuły omawiają łącznie trzy pacjentki z rakiem jajnika i sposób, w jaki ich leczenie zostało zmodyfikowane z powodu obecnej pandemii. Tylko dwie z trzech pacjentek z rakiem jajnika uzyskały wynik pozytywny na obecność nowego koronawirusa i wymagały adiuwantowego leczenia płytkami krwi z powodu rozwoju małopłytkowości związanej z chemioterapią. Pozostała pacjentka z rakiem jajnika, u której przeprowadzono badanie, uzyskała wynik negatywny w kierunku zakażenia SARS-CoV-2, ale na podstawie objawów i wyników badań klinicznych (np. nieprawidłowe wyniki tomografii komputerowej zgodne z zapaleniem płuc u pacjentów z COVID-19) przypuszczano, że wynik jest pozytywny. Schemat leczenia nowotworu u tego pacjenta został odroczony do czasu ustąpienia prezentowanego atypowego zapalenia płuc, ale poza tym nie otrzymał on żadnej terapii adiuwantowej. Obecnie nie ma globalnie akceptowanych wytycznych dotyczących postępowania z chorymi na nowotwory w warunkach pandemii z powodu braku dostępnych danych. Ostatnio międzynarodowa współpraca zaproponowała serię praktycznych podejść do diagnozowania i leczenia pacjentów z rakiem. Jednakże, dopóki więcej informacji lub skuteczny schemat terapeutyczny przeciwko SARS-CoV-2 nie staną się dostępne, pacjenci z rakiem będą nadal pozostawać w grupie bardzo wysokiego ryzyka śmiertelności z powodu epidemii COVID-19.
Withaferin a jako leczenie prospektywne
Withaferin A (WFA) jest steroidowym laktonem wyizolowanym z rośliny Withania somnifera, znanej również jako Ashwagandha. Jest znana ze swoich właściwości przeciwzapalnych, jak również właściwości antynowotworowych. Ostatnie prace wykazały, że infekcje COVID-19 mają duży komponent immunologiczny i mogą prowadzić do rozwoju burzy cytokinowej, potencjalnie zagrażającej życiu reakcji immunologicznej, w której organizm uwalnia do krwi zbyt wiele cytokin w szybkim tempie. Prace z naszego laboratorium wykazały, że WFA jest w stanie zmniejszyć wydzielanie różnych cytokin prozapalnych (np. TNFα, IL-6, IL-8 i IL-18) w modelu przerzutowego raka jajnika. Niewykluczone, że leczenie WFA może zmniejszyć intensywność burzy cytokinowej ze względu na opisywane właściwości przeciwzapalne. Co ciekawe, co najmniej trzy niezależne grupy badawcze zasugerowały, że fitochemikalia występujące w roślinie Withania somnifera mogą być opracowane jako środek terapeutyczny przeciwko infekcji COVID-19 przy użyciu metod dokowania molekularnego. Dwie z tych grup podały, że różne Withanolidy, takie jak WFA, powinny być zdolne do wiązania się z domeną wiążącą receptora wirusowego białka S, blokując w ten sposób lub zmniejszając interakcje z receptorem ACE2 gospodarza. Trzecia grupa podała, że WFA i oddzielny withanolid, Withanone, mają oddziaływać z główną proteazą SARS-CoV-2, chociaż przewiduje się, że WFA ma mniejsze powinowactwo wiążące niż ustalony inhibitor proteazy N3 używany do podstawowych wyników dokowania .
W niepowiązanym badaniu, nasza grupa bada WFA jako potencjalną terapię w leczeniu raka, w tym celowanie w komórki macierzyste raka i kacheksję wywołaną rakiem (zaburzenie powodujące utratę mięśni). Ponieważ sygnalizacja Ang-II jest znanym mediatorem atrofii mięśni szkieletowych, zbadaliśmy wpływ WFA na sygnalizację Ang-II, jak to się odnosi do wyniszczenia. Dane (w trakcie publikacji) z naszego laboratorium wskazują, że leczenie WFA może zmniejszyć krążący poziom angiotensyny II w eksperymentalnym modelu wyniszczenia spowodowanego nowotworem. W tym badaniu, ksenograftowaliśmy linię komórkową raka jajnika A2780 (8,0 × 105 komórek niskiego pasażu zawieszonych w 100 μl sterylnego PBS) dootrzewnowo do 5 do 6-tygodniowych samic myszy NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557). Kontrole wolne od guzów otrzymały równoważną iniekcję i.p. sterylnej soli fizjologicznej. Po 8-dniowym okresie refrakcji, aby umożliwić wszczepienie komórek raka jajnika, zwierzęta bez guza i z guzem otrzymywały iniekcje i.p. WFA (2 mg/kg) lub nośnik (10% dimetylosulfotlenek, 90% trioktanian glicerolu) raz na 3 dni przez okres 4 tygodni (post-xenografting).
Używając qPCR i starterów specyficznych dla genów, stwierdziliśmy, że leczenie WFA zmniejszyło względną ekspresję mRNA AT1R (receptor angiotensyny II typu 1) w porównaniu z grupą leczoną pojazdem w próbkach guza, jak określono w dwukierunkowej analizie wariancji (ANOVA), po której nastąpiła analiza post hoc testu wielokrotnego porównania Tukeya. W oparciu o nasze odkrycia i niezależnie przedstawione badania dokowania molekularnego, sprawdziliśmy czy leczenie WFA zmieni ekspresję ACE2 w płucach w warunkach wolnych od guza i w warunkach, w których znajduje się guz. Co ciekawe, nie znaleźliśmy znaczących różnic (NSD; p-values > 0,80 dla wszystkich porównań) we względnej ekspresji mRNA ACE2 w odpowiedzi na leczenie WFA, jak określono za pomocą dwukierunkowej ANOVA (ryc. 1). Ponieważ nie zaobserwowaliśmy żadnych znaczących różnic w ekspresji mRNA ACE2 w płucach za pomocą qPCR, jednego z głównych regionów, w których ACE2 ulega ekspresji, nie badaliśmy ekspresji ACE2 w innych narządach. Jednakże, ostatnio doniesiono, że jako produkt uboczny infekcji SARS-CoV-2, ekspresja ACE2 jest zmniejszona jako część procesu chorobowego, co z kolei ułatwia rozwój uszkodzeń wielonarządowych. Ze względu na ten efekt, inni sugerują, że blokowanie wiązania SARS-CoV-2 z receptorem ACE2 może być korzystniejszą strategią walki z wirusem niż zwiększanie ekspresji ACE2, ze względu na jego antagonistyczny wpływ na sygnalizację AT1R. Zgodnie z tym rozumowaniem, jest to w sferze możliwości, że WFA może blokować lub utrudniać COVID-19 poprzez interakcje z wirusowym białkiem S w oparciu o badania dokowania molekularnego, bez wpływu na ekspresję ACE2 (jak zgłoszono w naszych danych), co prowadzi do pogorszenia stanu patologicznego.
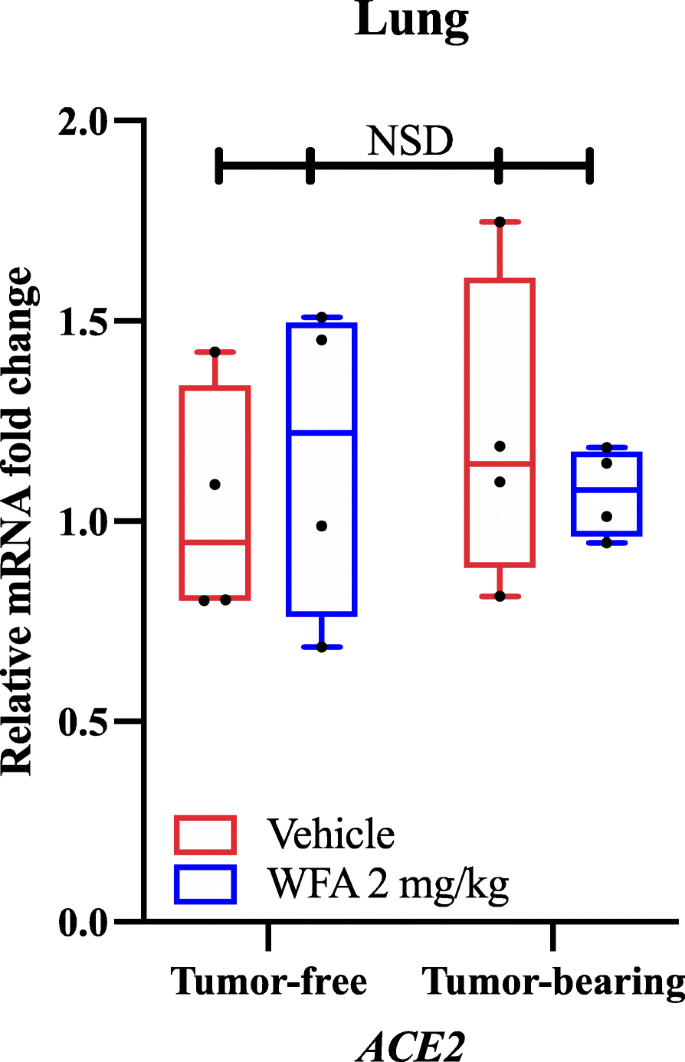
Wpływ litaferyny A na ekspresję ACE2 mRNA. (A) Względne poziomy mRNA dla ACE2 w próbkach płuc samic myszy NSG bez guza i z guzem jajnika A2780, którym podawano pojazd lub WFA (2 mg/kg). N = 4-5 myszy na grupę. Czarne kółka wskazują poszczególne punkty danych. NSD = brak istotnych różnic
.