Withaferin A : un agent thérapeutique potentiel contre l’infection COVID-19
La nouvelle maladie à coronavirus 2019 (COVID-19) s’est rapidement répandue dans le monde depuis qu’elle a été signalée pour la première fois en décembre 2019 au sein de Wuhan, en Chine, comme une pneumonie d’étiologie inconnue . Le syndrome respiratoire aigu sévère coronavirus-2 (SRAS-CoV-2), désigné par l’Organisation mondiale de la santé (OMS), représente la troisième épidémie à grande échelle liée aux coronavirus . Bien que la maladie ait été signalée pour la première fois en Chine, une étude rétrospective a permis d’établir que le SRAS-CoV-2 se propageait en France 4 jours avant qu’il ne soit signalé pour la première fois à Wuhan, en Chine, et 1 mois avant le premier cas officiel dans le pays. Depuis sa découverte initiale, le SRAS-CoV-2 s’est propagé dans le monde entier, infectant plus de 11,5 millions de personnes et entraînant la mort de plus de 530 000 personnes au 6 juillet 2020 . La gravité de la maladie varie largement, allant d’un état asymptomatique à des patients présentant un syndrome de détresse respiratoire aiguë (SDRA), nécessitant une intervention médicale critique pour tenter d’empêcher le décès du patient. On a découvert par la suite que l’enzyme 2 de conversion de l’angiotensine (ECA2) est un récepteur fonctionnel de la protéine spike (S-) du SRAS-CoV-2, qui permet au virus de pénétrer dans les cellules. L’ACE2 est un puissant régulateur négatif du système rénine-angiotensine (SRA), qui est essentiel au maintien de l’homéostasie du SRA.
Le gène de l’ACE2 est composé de 805 acides aminés et est une glycoprotéine de type I à membrane intégrale. L’ACE2 dégrade l’angiotensine (Ang)-II, un puissant vasoconstricteur (qui est également pro-inflammatoire et favorise la fibrose), et le convertit en Ang (1-7) . L’Ang (1-7) est un vasodilatateur qui inhibe également la prolifération et l’apoptose. Outre son effet systémique sur la régulation de la pression artérielle, l’ACE2 a des effets régulateurs locaux sur les changements pathologiques de plusieurs organes, notamment le cœur, les reins et les poumons. L’ACE2 est fortement exprimée dans les cellules alvéolaires des poumons, ce qui constitue le principal point d’entrée du virus dans l’hôte humain. Outre l’expression de l’ACE2 dans les cellules alvéolaires pulmonaires, elle est également exprimée dans divers tissus, notamment le système vasculaire (cellules endothéliales, cellules angiogènes migratrices et cellules musculaires lisses vasculaires), le cœur (cardiofibroblastes, cardiomyocytes, cellules endothéliales, péricytes et cellules adipeuses épicardiques) et les reins (cellules endothéliales glomérulaires, podocytes et cellules épithéliales des tubules proximaux), le foie (cholangiocytes et hépatocytes), la rétine (cellules épithéliales pigmentées, cellules photoréceptrices des bâtonnets et des cônes, et cellules gliales de Müller), les entérocytes des intestins, les organes circumventriculaires du système nerveux central, et les voies aériennes supérieures (cellules épithéliales en gobelet et ciliées) .
Il existe deux sous-unités de la protéine S du SRAS-CoV-2 : la sous-unité S1 possède un domaine de liaison au récepteur qui s’engage avec le récepteur ACE2 de la cellule hôte, et la sous-unité S2 est impliquée dans la régulation de la fusion entre la membrane virale et la membrane hôte . Il a été signalé que le SRAS-CoV-2 a une affinité dix fois plus élevée pour l’ACE2 que le SRAS-CoV, ce qui est cohérent avec l’efficacité supérieure de l’infection par le SRAS-CoV-2. Bien qu’aucun remède n’ait été trouvé à l’heure actuelle, plusieurs essais cliniques sont en cours pour déterminer quel est le traitement le plus efficace contre le COVID-19, avec une liste exhaustive de thérapies potentielles détaillées dans une revue de Gosain et al . Actuellement, la prise en charge des patients comprend un traitement de soutien et des mesures visant à empêcher la propagation du virus. Malgré les différences dans les caractéristiques des populations de patients entre l’Europe et la Chine, deux des principaux déterminants du risque de mortalité des patients qui ont été trouvés dans les deux groupes sont l’âge et la présence d’états de comorbidité sous-jacents. L’une de ces conditions sous-jacentes associées à une augmentation de la mortalité des patients atteints du COVID-19 est la présence d’un cancer .
Les patients atteints de cancer et l’épidémie de COVID-19
En raison de leur statut potentiellement immunodéprimé, le traitement approprié des patients atteints de cancer est un problème réel et sérieux auquel sont confrontés les oncologues, que le patient soit ou non atteint d’une infection par le SRAS-CoV-2 . Des données provenant de quatre points chauds du SRAS-CoV-2 (les États-Unis, l’Italie, l’Espagne et la Chine) ont montré que les patients cancéreux infectés par le nouveau coronavirus présentent un risque significativement accru d’admission dans une unité de soins intensifs (USI) et/ou de ventilation mécanique, ainsi qu’une augmentation de la mortalité des patients . Une étude rétrospective a révélé que le taux de mortalité des patients cancéreux infectés par le COVID-19 en Chine était d’environ 28 %, alors que le taux de mortalité symptomatique global était de 1,4 % ou le taux de mortalité brut de 4,5 % en Chine. Il n’est peut-être pas surprenant que le taux de mortalité des patients atteints d’un cancer du poumon et infectés par le SRAS-CoV-2 soit assez sombre, une étude de cohorte réalisée à New York ayant révélé un taux de mortalité de 55 %. Les patients atteints de cancer et leurs oncologues sont actuellement confrontés au dilemme suivant : le patient doit-il ou non commencer ou poursuivre un traitement pour sa maladie primaire en raison des risques associés à la contraction du SRAS-CoV-2 et de la réduction des ressources disponibles pour les travailleurs de la santé ? Les informations sur l’étiologie spécifique du cancer sont rares dans plusieurs études sur le SRAS-CoV-2. Cependant, des cancers du poumon, du sein, de l’appareil digestif et des cancers hématologiques (ex. : lymphome) ont été signalés dans les études de cohorte COVID-19 aux États-Unis, en Italie et en Chine. De plus, des patientes atteintes d’un cancer du col de l’utérus et d’autres tumeurs gynécologiques non spécifiées ont été signalées dans ces études.
Bien que certaines sources documentaires donnent un aperçu des paradigmes oncologiques exposés, la population de patients évaluée, déjà restreinte, diminue encore plus lorsqu’elle est stratifiée par typage oncologique. Il s’agit là d’une limite importante pour l’évaluation du risque de mortalité et l’élaboration de directives pour la prise en charge des patients cancéreux COVID-19-positifs. Dans le même ordre d’idées, on sait très peu de choses sur l’infection par le COVID-19 chez les patients atteints de cancer de l’ovaire. Au moment de la rédaction de cet article, il existe 22 articles PubMed sur le sujet, dont 20 traitent des changements potentiels ou des défis auxquels sont confrontés les centres anticancéreux pour mieux servir les patientes atteintes de cancer de l’ovaire. Les deux autres articles traitent de trois patientes atteintes d’un cancer de l’ovaire et de la façon dont leur traitement a été modifié en raison de la pandémie actuelle. Seules deux des trois patientes atteintes d’un cancer de l’ovaire se sont révélées positives au nouveau coronavirus, nécessitant un traitement adjuvant par plaquettes en raison de l’apparition d’une thrombocytopénie liée à la chimiothérapie. La patiente restante, atteinte d’un cancer de l’ovaire, a été testée négative pour l’infection par le SRAS-CoV-2, mais on a présumé qu’elle était positive sur la base des symptômes et des résultats cliniques de la patiente (par exemple, résultats anormaux de la tomodensitométrie correspondant à une pneumonie chez les patients atteints de COVID-19). Le traitement anticancéreux de ce patient a été retardé jusqu’à la résolution de la pneumonie atypique, mais il n’a pas reçu de traitement adjuvant. À l’heure actuelle, il n’existe pas de lignes directrices mondialement reconnues pour la prise en charge des patients atteints de cancer dans le contexte d’une pandémie, en raison du manque de données disponibles. Récemment, une collaboration internationale a proposé une série d’approches pratiques pour le diagnostic et le traitement des patients atteints de cancer. Cependant, jusqu’à ce que plus d’informations ou un régime thérapeutique efficace contre le SRAS-CoV-2 deviennent disponibles, les patients atteints de cancer continueront à rester à un risque très élevé de mortalité en raison de l’épidémie de COVID-19 .
La withaferine a comme traitement prospectif
La withaferine A (WFA) est une lactone stéroïdienne isolée de la plante Withania somnifera, également connue sous le nom d’Ashwagandha . Elle est connue pour ses propriétés anti-inflammatoires, ainsi que pour ses propriétés anti-tumorigènes . Des travaux récents ont démontré que les infections à COVID-19 ont une composante immunitaire importante et peuvent entraîner le développement d’une tempête de cytokines, une réaction immunitaire potentiellement mortelle dans laquelle le corps libère trop de cytokines dans le sang à un rythme rapide . Les travaux de notre laboratoire ont démontré que l’AGT est capable de réduire la sécrétion de diverses cytokines pro-inflammatoires (ex. TNFα, IL-6, IL-8 et IL-18) dans un modèle métastatique de cancer de l’ovaire. Il est tout à fait possible que le traitement par l’AGR puisse abroger l’intensité de la tempête de cytokines en raison de ses propriétés anti-inflammatoires. Il est intéressant de noter qu’au moins trois groupes de recherche indépendants ont suggéré que les substances phytochimiques présentes dans la plante Withania somnifera pourraient être développées comme agent thérapeutique contre l’infection par le COVID-19 en utilisant des approches de docking moléculaire. Deux de ces groupes ont indiqué que divers Withanolides, tels que l’AGF, devraient être capables de se lier au domaine de liaison du récepteur de la protéine S virale, bloquant ou réduisant ainsi les interactions avec le récepteur ACE2 de l’hôte. Le troisième groupe a rapporté que l’AGW et un autre withanolide, la Withanone, sont censés interagir avec la protéase principale du SRAS-CoV-2, bien que l’AGW soit censé avoir une affinité de liaison inférieure à celle d’un inhibiteur de protéase N3 établi utilisé pour les scores d’arrimage de base.
Dans une étude sans rapport, notre groupe a étudié l’AGW comme thérapie potentielle pour traiter le cancer, y compris le ciblage des cellules souches cancéreuses et la cachexie induite par le cancer (un trouble de perte musculaire). Comme la signalisation de l’Ang-II est un médiateur connu de l’atrophie des muscles squelettiques, nous avons étudié l’effet de l’AGW sur la signalisation de l’Ang-II dans le cadre de la cachexie. Des données (en cours de publication) de notre laboratoire ont indiqué que le traitement par l’AGB peut réduire les niveaux circulants d’Angiotensine II dans un modèle expérimental de cachexie induite par le cancer. Dans cette étude, nous avons xénogreffé la lignée cellulaire de cancer de l’ovaire A2780 (8,0 × 105 cellules de faible passage remises en suspension dans 100 μl de PBS stérile) par voie intrapéritonéale à des souris femelles NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG ; Jackson Lab Strain # 005557) âgées de 5 à 6 semaines. Les témoins sans tumeur ont reçu une injection i.p. équivalente de solution saline stérile. Après une période réfractaire de 8 jours pour permettre la prise de greffe des cellules cancéreuses ovariennes, les animaux sans tumeur et les animaux porteurs de tumeur ont reçu des injections i.p. de WFA (2 mg/kg) ou de véhicule (diméthylsulfoxyde à 10%, trioctanoate de glycérol à 90%) une fois tous les 3 jours sur une période de 4 semaines (post-xénogreffe).
À l’aide de la qPCR et d’amorces spécifiques aux gènes, nous avons constaté que le traitement par l’AGW réduisait l’expression relative de l’ARNm de l’AT1R (récepteur de l’angiotensine II de type 1) par rapport au groupe traité par le véhicule dans les échantillons de tumeurs, comme l’a déterminé une analyse de variance (ANOVA) à deux voies suivie d’une analyse post hoc par le test de comparaison multiple de Tukey. Sur la base de nos résultats et des études d’accostage moléculaire rapportées indépendamment, nous avons cherché à savoir si le traitement par l’AGO modifierait ou non l’expression de l’ACE2 dans les poumons dans des conditions sans tumeur et avec tumeur. Il est intéressant de noter que nous n’avons pas trouvé de différences significatives (NSD ; valeurs p > 0,80 pour toutes les comparaisons) dans l’expression relative de l’ARNm de l’ACE2 en réponse au traitement par les AGW, comme l’a déterminé une ANOVA à deux voies (Fig. 1). Comme nous n’avons pas observé de différences significatives dans l’expression de l’ARNm de l’ACE2 dans les poumons par qPCR, l’une des principales régions où l’ACE2 est exprimée, nous n’avons pas étudié l’expression de l’ACE2 dans d’autres organes. Cependant, il a été récemment signalé que, en tant que sous-produit de l’infection par le SRAS-CoV-2, l’expression de l’ACE2 est réduite dans le cadre du processus pathologique, ce qui facilite le développement de lésions multiorganiques. En raison de cet effet, d’autres ont suggéré que le blocage de la liaison du SRAS-CoV-2 au récepteur de l’ACE2 pourrait être une stratégie plus bénéfique pour combattre le virus que l’augmentation de l’expression de l’ACE2, en raison de son effet antagoniste sur la signalisation de l’AT1R. Dans la lignée de ce raisonnement, il est possible que l’AGF puisse bloquer ou entraver COVID-19 par des interactions avec la protéine S virale sur la base des études de docking moléculaire , sans affecter l’expression de l’ECA2 (comme indiqué dans nos données) conduisant à une aggravation de l’état pathologique.
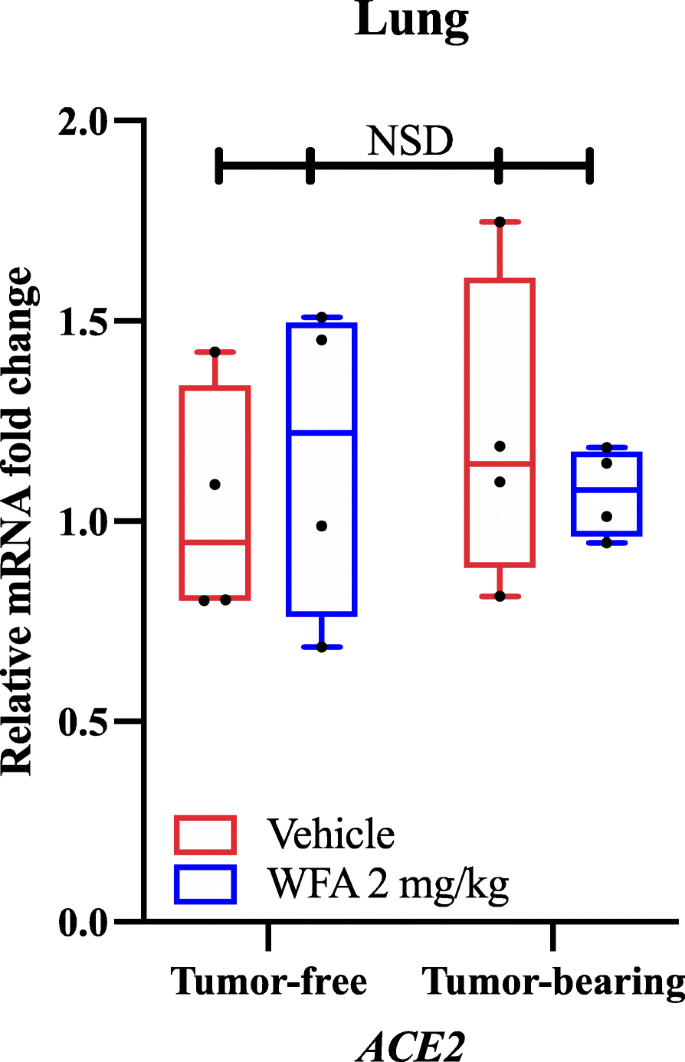
Effet de la Withaferin A sur l’expression de l’ARNm de l’ACE2. (A) Niveaux relatifs d’ARNm de l’ACE2 dans les échantillons pulmonaires de souris NSG femelles sans tumeur et porteuses de la tumeur ovarienne A2780, traitées par véhicule ou par WFA (2 mg/kg). N = 4-5 souris par groupe. Les cercles noirs indiquent les points de données individuels. NSD = Pas de différences significatives
.