Withaferin A: un potenziale agente terapeutico contro l’infezione COVID-19
Il nuovo coronavirus 2019 (COVID-19) si è rapidamente diffuso in tutto il mondo da quando è stato segnalato per la prima volta nel dicembre 2019 a Wuhan, Cina, come una polmonite di eziologia sconosciuta. La sindrome respiratoria acuta grave coronavirus-2 (SARS-CoV-2), definita dall’Organizzazione mondiale della sanità (OMS), rappresenta la terza epidemia su larga scala legata ai coronavirus . Anche se la malattia è stata segnalata per la prima volta in Cina, uno studio retrospettivo ha successivamente trovato prove che la SARS-CoV-2 si stava diffondendo in Francia 4 giorni prima che fosse segnalata per la prima volta a Wuhan, in Cina, e 1 mese prima del primo caso ufficiale nel paese. Dalla sua scoperta iniziale, la SARS-CoV-2 si è diffusa in tutto il mondo, infettando oltre 11,5 milioni di persone e causando la morte di più di 530.000 persone a partire dal 6 luglio 2020. La gravità della malattia varia ampiamente da uno stato di malattia asintomatico a pazienti che presentano una sindrome da distress respiratorio acuto (ARDS), che richiede un intervento medico critico per cercare di prevenire la morte del paziente. Successivamente è stato scoperto che l’enzima di conversione dell’angiotensina 2 (ACE2) è un recettore funzionale per la proteina SARS-CoV-2 spike (S-), permettendo al virus di entrare nelle cellule. ACE2 è un potente regolatore negativo del sistema renina-angiotensina (RAS), che è fondamentale per mantenere l’omeostasi del RAS.
Il gene ACE2 è composto da 805 aminoacidi ed è una glicoproteina integrale di membrana di tipo I. ACE2 degrada l’angiotensina (Ang)-II, un potente vasocostrittore (che è anche pro-infiammatorio e promuove la fibrosi), e lo converte in Ang (1-7) . Ang (1-7) è un vasodilatatore, che inibisce anche la proliferazione e l’apoptosi. Oltre all’effetto sistemico sulla regolazione della pressione sanguigna, ACE2 ha effetti regolatori locali nei cambiamenti patologici di diversi organi, tra cui il cuore, il rene e i polmoni. ACE2 è altamente espresso nelle cellule alveolari del polmone, fornendo il principale sito di ingresso del virus nell’ospite umano. Oltre all’espressione di ACE2 nelle cellule alveolari polmonari, è anche espresso in vari tessuti, tra cui: il sistema vascolare (cellule endoteliali, cellule angiogeniche migratorie e cellule muscolari lisce vascolari), cuore (cardiofibroblasti, cardiomiociti, cellule endoteliali, periciti e cellule adipose epicardiche) e reni (cellule endoteliali glomerulari, podociti e cellule epiteliali del tubulo prossimale) fegato (colangiociti ed epatociti), retina (cellule epiteliali pigmentate, cellule fotorecettrici a bastoncello e cono, e cellule gliali di Müller), enterociti dell’intestino, organi circumventricolari del sistema nervoso centrale, e le vie aeree superiori (cellule epiteliali a calice e ciliate) .
Ci sono due subunità della proteina S della SARS-CoV-2: la subunità S1 ha un dominio di legame con il recettore ACE2 della cellula ospite, e la subunità S2 è coinvolta nella regolazione della fusione tra la membrana virale e quella ospite. È stato riportato che il SARS-CoV-2 ha un’affinità dieci volte maggiore per l’ACE2 rispetto al SARS-CoV, il che è coerente con la maggiore efficienza di infezione del SARS-CoV-2. Anche se attualmente non è stata trovata alcuna cura, sono in corso diversi studi clinici per determinare quale sia il regime di trattamento più efficace per la COVID-19, con un ampio elenco di potenziali terapie dettagliate in una revisione di Gosain et al. Attualmente, la gestione dei pazienti prevede un trattamento di supporto e misure per prevenire l’ulteriore diffusione del virus. Nonostante le differenze nelle caratteristiche della popolazione dei pazienti tra Europa e Cina, due dei principali determinanti del rischio di mortalità dei pazienti che sono stati trovati in entrambi i gruppi sono l’età e la presenza di condizioni comorbide sottostanti. Una di queste condizioni di base associata a un aumento della mortalità dei pazienti affetti da COVID-19 è la presenza di cancro.
I pazienti affetti da cancro e l’epidemia di COVID-19
A causa del loro stato potenzialmente immunocompromesso, il trattamento adeguato dei pazienti affetti da cancro è un problema reale e serio che gli oncologi devono affrontare, indipendentemente dal fatto che il paziente sia affetto da un’infezione da SARS-CoV-2. I dati provenienti da quattro punti caldi della SARS-CoV-2 (Stati Uniti, Italia, Spagna e Cina) hanno dimostrato che i pazienti oncologici infettati dal nuovo coronavirus hanno un rischio significativamente maggiore di ricovero in un’unità di terapia intensiva (ICU) e/o di richiedere la ventilazione meccanica, così come un aumento della mortalità del paziente. In uno studio retrospettivo, il tasso di mortalità per i pazienti affetti da cancro in Cina infettati da COVID-19 è risultato essere di circa il 28%, rispetto al tasso di mortalità sintomatico complessivo dell’1,4% o il tasso di mortalità grezzo del 4,5% in Cina. Forse non sorprende che il tasso di mortalità dei pazienti con cancro ai polmoni con SARS-CoV-2 sia stato abbastanza triste, con uno studio di coorte di New York che ha mostrato un tasso di mortalità del 55%. I pazienti affetti da cancro e i loro oncologi si trovano attualmente di fronte al dilemma se il paziente debba o meno iniziare o continuare la terapia per la loro malattia primaria a causa dei rischi associati di contrarre la SARS-CoV-2 e della riduzione delle risorse disponibili per gli operatori sanitari. Le informazioni sull’eziologia specifica del cancro sono scarse in diversi studi sulla SARS-CoV-2. Tuttavia, all’interno degli studi di coorte COVID-19 negli Stati Uniti, in Italia e in Cina sono stati riportati tumori ai polmoni, al seno, gastrointestinali ed ematologici (es. linfoma). Inoltre, pazienti con cancro cervicale e pazienti con altre neoplasie ginecologiche non specificate sono stati segnalati in questi studi.
Mentre alcune fonti della letteratura forniscono scorci dei paradigmi oncologici esposti, la già piccola popolazione di pazienti valutata diminuisce ulteriormente se stratificata per tipologia oncologica. Questa è una limitazione sostanziale per valutare il rischio di mortalità e fornire linee guida per la gestione dei pazienti oncologici COVID-19-positivi. Lungo linee simili, si sa molto poco sull’infezione da COVID-19 nelle pazienti con cancro ovarico. Al momento in cui scriviamo, ci sono 22 articoli PubMed sull’argomento, di cui 20 discutono i potenziali cambiamenti o le sfide affrontate dalle cliniche oncologiche per servire meglio le pazienti con cancro ovarico. I restanti due articoli discutono un totale di tre pazienti con cancro ovarico e come il loro trattamento è stato modificato a causa dell’attuale pandemia. Solo due dei tre pazienti con cancro ovarico sono risultati positivi al nuovo coronavirus, richiedendo un trattamento adiuvante con piastrine a causa dello sviluppo di trombocitopenia legata alla chemioterapia. Il restante paziente con cancro ovarico discusso è risultato negativo all’infezione da SARS-CoV-2, ma si presumeva che fosse positivo sulla base dei sintomi del paziente e dei risultati clinici (ad esempio, risultati anomali della TAC coerenti con la polmonite nei pazienti COVID-19). Il regime oncologico di questo paziente è stato ritardato fino alla risoluzione della polmonite atipica presente, ma altrimenti non ha ricevuto alcuna terapia adiuvante. Attualmente, non ci sono linee guida accettate a livello globale per affrontare la gestione dei pazienti affetti da cancro nelle impostazioni di una pandemia a causa della mancanza di dati disponibili. Recentemente, una collaborazione internazionale ha proposto una serie di approcci pratici per la diagnosi e il trattamento dei pazienti oncologici. Tuttavia, fino a quando non saranno disponibili maggiori informazioni o un regime terapeutico efficace contro la SARS-CoV-2, i pazienti oncologici continueranno a rimanere ad un rischio molto elevato di mortalità a causa dell’epidemia di COVID-19.
Withaferin a come trattamento prospettico
Withaferin A (WFA) è un lattone steroideo isolato dalla pianta Withania somnifera, nota anche come Ashwagandha . È noto per le sue proprietà antinfiammatorie, così come le sue proprietà antitumorali. Un lavoro recente ha dimostrato che le infezioni da COVID-19 hanno una grande componente immunitaria e possono portare allo sviluppo della tempesta di citochine, una reazione immunitaria potenzialmente pericolosa in cui il corpo rilascia troppe citochine nel sangue ad un ritmo rapido. Il lavoro del nostro laboratorio ha dimostrato che la WFA è in grado di ridurre la secrezione di varie citochine proinfiammatorie (es. TNFα, IL-6, IL-8 e IL-18) in un modello metastatico di cancro ovarico. È nel regno della possibilità che il trattamento WFA può abrogare l’intensità della tempesta di citochine a causa delle proprietà antinfiammatorie riportate. È interessante notare che almeno tre gruppi di ricerca indipendenti hanno suggerito che le sostanze fitochimiche trovate nella pianta Withania somnifera potrebbero essere sviluppate come agente terapeutico contro l’infezione COVID-19 utilizzando approcci di docking molecolare. Due dei gruppi hanno riferito che vari Withanolidi, come il WFA, dovrebbero essere in grado di legarsi al dominio di legame del recettore della proteina S virale, bloccando o riducendo così le interazioni con il recettore ACE2 dell’ospite. Il terzo gruppo ha riferito che WFA e un withanolide separato, Withanone, sono previsti per interagire con la proteasi principale di SARS-CoV-2, anche se WFA è previsto per avere meno di un’affinità di legame rispetto a un inibitore di proteasi N3 stabilito utilizzato per i punteggi di docking di base.
In uno studio non correlato, il nostro gruppo ha studiato WFA come un potenziale terapeutico per trattare il cancro, compreso il targeting delle cellule staminali del cancro e la cachessia indotta dal cancro (un disturbo di spreco muscolare). Poiché la segnalazione dell’Ang-II è un noto mediatore dell’atrofia del muscolo scheletrico, abbiamo studiato l’effetto della WFA sulla segnalazione dell’Ang-II per quanto riguarda la cachessia. I dati (in corso di pubblicazione) dal nostro laboratorio hanno indicato che il trattamento WFA può ridurre i livelli circolanti di Angiotensina II in un modello sperimentale di cachessia indotta dal cancro. In questo studio, abbiamo xenotrapiantato la linea cellulare del cancro ovarico A2780 (8.0 × 105 cellule a basso passaggio risospese in 100 μl PBS sterile) per via intraperitoneale in 5 a 6 settimane vecchie femmine NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557) topi. I controlli senza tumore hanno ricevuto un’equivalente iniezione i.p. di soluzione fisiologica sterile. Dopo un 8 giorni di periodo refrattario per consentire l’incisione delle cellule del cancro ovarico, animali senza tumore e tumore-cuscinetto hanno ricevuto iniezioni i.p. di WFA (2 mg / kg) o veicolo (10% dimetilsolfossido, 90% glicerolo trioctanoato) una volta ogni 3 giorni per il periodo di 4 settimane (post-xenotrapianto).
Utilizzando qPCR e primer specifici del gene, abbiamo trovato che il trattamento WFA ha ridotto l’espressione mRNA relativa di AT1R (Angiotensin II Receptor Type 1) rispetto al gruppo trattato con il veicolo nei campioni di tumore come determinato da un’analisi a due vie della varianza (ANOVA) seguita dal test di confronto multiplo di Tukey analisi post hoc. Sulla base dei nostri risultati e gli studi di docking molecolare riportati in modo indipendente, abbiamo indagato se il trattamento WFA alterasse o meno l’espressione di ACE2 nei polmoni in condizioni di assenza di tumore e di portatori di tumore. È interessante notare che non abbiamo trovato differenze significative (NSD; p-valori > 0,80 per tutti i confronti) nell’espressione mRNA relativa di ACE2 in risposta al trattamento WFA come determinato da un ANOVA a due vie (Fig. 1). Come non abbiamo osservato alcuna differenza significativa nell’espressione dell’mRNA di ACE2 nei polmoni tramite qPCR, una delle regioni primarie dove ACE2 è espresso, non abbiamo studiato l’espressione di ACE2 in altri organi. Tuttavia, è stato recentemente riportato che, come sottoprodotto dell’infezione da SARS-CoV-2, l’espressione di ACE2 è diminuita come parte del processo della malattia, che a sua volta facilita lo sviluppo del danno multiorgano. A causa di questo effetto, altri hanno suggerito che bloccare il legame della SARS-CoV-2 al recettore ACE2 può essere una strategia più vantaggiosa per combattere il virus che aumentare l’espressione di ACE2, a causa del suo effetto antagonista sulla segnalazione AT1R. In linea con questa logica, è nel regno della possibilità che WFA può bloccare o impedire COVID-19 attraverso interazioni con la proteina S virale sulla base degli studi di docking molecolare, senza influenzare l’espressione di ACE2 (come riportato nei nostri dati) portando ad un peggioramento dello stato patologico.
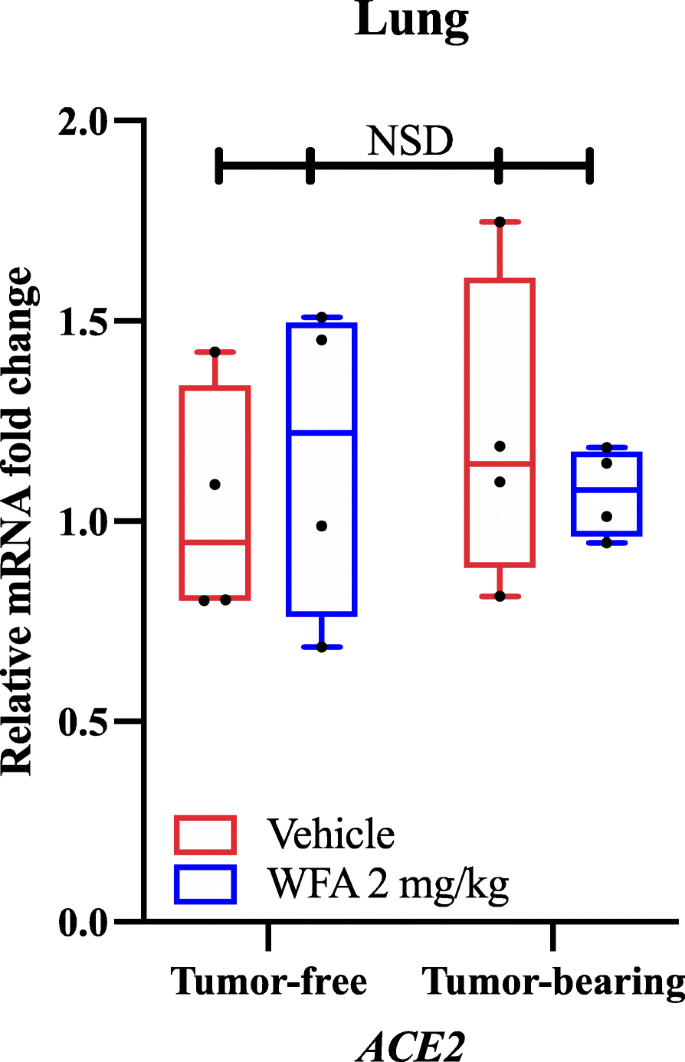
L’effetto di Withaferin A sull’espressione di ACE2 mRNA. (A) Livelli relativi di mRNA di ACE2 in campioni polmonari di topi NSG femmina senza tumore e con tumore ovarico A2780 trattati con veicolo o WFA (2 mg/kg). N = 4-5 topi per gruppo. I cerchi neri indicano i singoli punti di dati. NSD = Nessuna differenza significativa