Objev a vývoj přímých inhibitorů faktoru Xa
Faktor Xa:

Faktory IIa, Xa, VIIa, IXa a XIa jsou proteolytické enzymy, které mají specifickou úlohu v koagulační kaskádě. Faktor Xa (FXa) je nejslibnější díky své pozici na průsečíku vnitřní a vnější dráhy a také díky tomu, že na každou molekulu Xa generuje přibližně 1000 molekul trombinu, což vede k silnému antikoagulačnímu účinku. FXa vzniká z FX štěpením aktivačního peptidu o 52 aminokyselinách, protože „a“ ve slově faktor Xa znamená aktivovaný. FXa se skládá z katalytické domény o 254 aminokyselinách a je také spojen s lehkým řetězcem o 142 aminokyselinách. Řetězec obsahuje jak GLA doménu, tak dvě domény epidermálního růstového faktoru (EGF like domains).
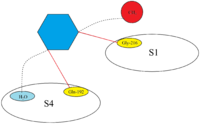
Aktivní místo FXa je strukturováno tak, aby katalyzovalo štěpení fyziologických substrátů, a štěpí PhePheAsnProArg-ThrPhe a TyrIleAspGlyArg-IleVal v protrombinu. FXa má čtyři tzv. kapsy, které jsou cílem pro substráty, jež se na faktor Xa vážou. Tyto kapsy jsou lemovány různými aminokyselinami a inhibitory Xa se při vazbě na faktor Xa zaměřují na tyto kapsy. Dvě nejvýznamnější kapsy z hlediska afinity a selektivity pro inhibitory faktoru Xa jsou S1 a S4.
S1: Kapsa S1 je hydrofobní kapsa a obsahuje zbytek kyseliny asparagové (Asp-189), který může sloužit jako rozpoznávací místo pro bazickou skupinu. FXa má v kapse S1 zbytkový prostor a je lemován zbytky Tyr-228, Asp-189 a Ser-195.
S2: Kapsa S2 je malá a mělká kapsa. Spojuje se s kapsou S4 a má prostor pro malé aminokyseliny. Zdá se, že Tyr-99 blokuje přístup do této kapsy, takže tato kapsa není tak důležitá jako S1 a S4.
S3: Kapsa S3 se nachází na okraji kapsy S1, je plochá a vystavená rozpouštědlu. Tato kapsa není tak důležitá jako kapsy S1 a S4.
S4: Kapsa S4 je hydrofobní povahy a dno kapsy je tvořeno zbytkem Trp-215. Kapsa S4 je hydrofobní. Zbytky Phe-174 a Tyr-99 FXa se spojují s Trp-215 a vytvářejí aromatický box, který je schopen vázat alifatické, aromatické a kladně nabité fragmenty. Vzhledem k vazbě na kladně nabité entity ji lze popsat jako kationtovou díru.
Chemická struktura a vlastnosti přímých inhibitorů XaEdit
| Rivaroxaban | Apixaban | Edoxaban | |
|---|---|---|---|
| MW (g/mol) | 436 | 460 | 548 |
| Molekula vzorec | C19H18ClN3O5S | C25H25N5O4 | C24H30ClN7O4S |
| Tvar | L | L | L |
| Ki | 0.4 nM | 0,08 nM | 0,561 nM |
| IC50 | 0.7 nM | N/A | N/A |
| Orální biologická dostupnost (%) | 66-100 (dávk.závislá na dávce) | 50 | 62 |

Vazba inhibitorů Xa na faktor XaEdit
Všechny inhibitory Xa se v aktivním místě faktoru Xa vážou takzvaně ve tvaru písmene „L“. Klíčovými složkami faktoru Xa jsou vazebná místa S1 a S4. Nejprve bylo zjištěno, že přírodní sloučeniny, antistasin a TAP, které mají vysoce polární, a tedy nabité složky, se vážou na cíl s určitou specifičností. Proto byla navržena novější léčiva s pozitivně nabitými skupinami, ale ta měla za následek špatnou biologickou dostupnost. V současnosti prodávané inhibitory Xa proto obsahují aromatický kruh s připojenými různými částmi pro různé interakce s vazebnými místy S1 a S4. To rovněž zajišťuje dobrou biologickou dostupnost i zachování pevné vazebné síly. Inhibitory Xa, které jsou v současné době na trhu, se proto spoléhají na hydrofobní a vodíkové vazby namísto vysoce polárních interakcí.
Vazba antistasinu na faktor XaEdit
Antistasin obsahuje N- a C-terminální doménu, které jsou si podobné v sekvencích aminokyselin s ~40% identitou a ~56% homologií. Každá z nich obsahuje krátkou β-listovou strukturu a 5 disulfidových vazeb. K inhibici Xa je nezbytná pouze N-koncová doména, zatímco C-koncová doména se na inhibičních vlastnostech nepodílí kvůli rozdílům v trojrozměrné struktuře, i když C-koncová doména má silně analogický vzor jako vlastní aktivní místo.
Interakce antistasinu s FXa zahrnuje jak aktivní místo, tak neaktivní povrch FXa. Reaktivní místo antistasinu tvořené Arg-34 a Val-35 v N-terminální doméně vyhovuje vazebnému místu FXa, nejspíše kapse S1. Zároveň Glu-15 nacházející se mimo reaktivní místo antistasinu vyhovuje kladně nabitým zbytkům na povrchu FXa. Vícenásobná vazba je termodynamicky výhodná a vede k subnanomolární inhibici (Ki = 0,3-0,6 nM).
DX-9065a se váže na faktor XaEdit
DX-9065a, první malá molekula přímého inhibitoru Xa, je amidinoarylový derivát s molekulovou hmotností 571,07 g/mol. Jeho kladně nabitá amidinonaftalenová skupina tvoří solný můstek ke zbytku Asp-189 v kapse S1 FXa. Pyrrolidinový kruh zapadá mezi Tyr-99, Phe-174 a Trp-215 v kapse S4 FXa.
Na rozdíl od starších léčiv, např. heparinu, je DX-9065a selektivní pro FXa ve srovnání s trombinem, i když FXa a trombin mají podobnou strukturu. To je způsobeno rozdílem v aminokyselinovém zbytku v pozici 192 homologu. Zatímco FXa má v této pozici glutaminový zbytek, trombin má kyselinu glutamovou, která způsobuje elektrostatickou repulzi s karboxylovou skupinou přípravku DX-9065a. Kromě toho solný můstek mezi Glu-97 trombinu a amidinovou skupinou fixovanou v pyrrolidinovém kruhu DX-9065a snižuje flexibilitu molekuly DX-9065a, která nyní nemůže rotovat natolik, aby se vyhnula elektrostatickému střetu. Proto je hodnota IC50 pro trombin >1000µM, zatímco hodnota IC50 pro FXa je 0,16µM.

Vazba rivaroxabanu na faktor XaEdit
Vazba rivaroxabanu na FXa je zprostředkována dvěma vodíkovými vazbami na aminokyselinu Gly-219. Vazba rivaroxabanu na faktor Xa je zajištěna dvěma vodíkovými vazbami. Tyto dvě vodíkové vazby plní důležitou úlohu směřující léčivo do subsites S1 a S4 FXa. První vodíková vazba je silná interakce, která vychází z karbonylového kyslíku oxazolidinonového jádra rivaroxabanu. Druhá vodíková vazba je slabší interakcí a pochází z aminoskupiny klorothiofenové karboxamidové části.
Tyto dvě vodíkové vazby vedou k tomu, že léčivo vytváří tvar písmene L a zapadá do kapes S1 a S4. Aminokyselinové zbytky Phe-174, Tyr-99 a Trp-215 tvoří úzký hydrofobní kanál, který je vazebnou kapsou S4. Morfolinonová část rivaroxabanu je „zasunuta“ mezi aminokyseliny Tyr-99 a Phe-174 a arylový kruh rivaroxabanu je orientován kolmo přes Trp-215. Karbonylová skupina morfolinonu nemá přímou interakci s páteří FXa, místo toho přispívá k planarizaci morfolinonového kruhu, a proto podporuje, aby byl rivaroxaban „sendvičován“ mezi oběma aminokyselinami.
Interakce mezi chlorovým substituentem thiofenové části a aromatickým kruhem Tyr-228, který se nachází ve spodní části S1, je velmi důležitá vzhledem k tomu, že odstraňuje potřebu silně bazických skupin pro vysokou afinitu k FXa. To umožňuje rivaroxabanu, který není bazický, dosáhnout dobré perorální biologické dostupnosti a účinnosti.
Vazba apixabanu na faktor XaEdit
Apixaban vykazuje podobný způsob vazby jako rivaroxaban a po připojení k FXa tvoří těsný komplex inhibitoru a enzymu. P-methoxy skupina apixabanu se připojuje k S1 kapse FXa, ale zdá se, že neinteraguje s žádnými zbytky v této oblasti FXa. Dusíkový atom pyrazolu N-2 apixabanu interaguje s Gln-192 a karbonylový kyslík interaguje s Gly-216. Fenylaktamová skupina apixabanu je umístěna mezi Tyr-99 a Phe-174 a díky své orientaci je schopna interagovat s Trp-215 kapsy S4. Karbonylová kyslíková skupina laktamové části interaguje s molekulou vody a zdá se, že neinteraguje s žádným zbytkem v kapse S4.

Vztah mezi strukturou a aktivitou (SAR)Edit
Důležitou součástí návrhu sloučeniny, která je ideálním inhibitorem určitého cíle, je pochopení sekvence aminokyselin cílového místa, na které se má sloučenina vázat. Modelování protrombinu i FXa umožňuje odečíst rozdíl a identifikovat aminokyseliny v každém vazebném místě. Ve spodní části kapsy S1 na FXa je vazebnou aminokyselinou Asp-189, na kterou se mohou vázat amidinové molekuly. Po rentgenovém vyšetření vazebného místa FXa se ukázalo, že kapsa S1 má planární tvar, což znamená, že by se do ní měla vázat plochá amidinoarylová skupina bez sterických překážek.
Moderní přímé inhibitory Xa jsou molekuly ve tvaru L, jejichž konce dokonale zapadají do kapes S1 a S4. Dlouhá strana tvaru L musí odpovídat vysoce specifickému tunelu v aktivním místě cíle. Aby se toho dosáhlo, je tato část molekul navržena tak, aby měla v této oblasti málo formálních interakcí s FXa. Protože nedochází ke specifické vazbě, zapadnutí těchto látek mezi kapsy FXa zvyšuje celkovou specifičnost léčiv k molekule FXa. Interakce mezi kapsou S1 FXa a inhibitorem může být iontová i neiontová, což je důležité, protože to umožňuje upravit design molekuly tak, aby se zvýšila perorální biologická dostupnost. Dříve navržené sloučeniny byly nabité molekuly, které se v gastrointestinálním traktu špatně vstřebávají, a proto nedosahovaly vysokých sérových koncentrací. Novější léčiva mají lepší biologickou dostupnost, protože nejsou nabité a mají neiontovou interakci s kapsou S1.
Rivaroxaban
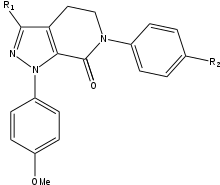
Během vývoje SAR rivaroxabanu si vědci uvědomili, že přidáním 5-chlorothiofen-2-karboxamidové skupiny k oxazolidoninovému jádru lze 200násobně zvýšit účinnost, která byla dříve pro lékařské použití příliš slabá. Kromě tohoto objevu byla potvrzena jasná preference (S)-konfigurace. Tato sloučenina měla slibný farmakokinetický profil a neobsahovala vysoce bazickou amidinovou skupinu, která však byla dříve považována za důležitou pro interakci s kapsou S1. Tato zjištění vedla k rozsáhlým výzkumům SAR (vztah struktury a aktivity). Během testování SAR byla skupina R1 definována jako nejdůležitější pro účinnost. Pyrrolidinon byl první funkční skupinou R1, která významně zvyšovala účinnost, ale další výzkumy odhalily ještě vyšší účinnost s morfolinonovou skupinou místo ní. Skupiny R2 a R3 měly připojený vodík nebo fluor a bylo rychle vyhodnoceno, že mít vodík vede k nejvyšší účinnosti. Skupiny R2 a R3 byly poté nahrazeny různými skupinami, které byly všechny méně účinné než vodík, takže konečným výsledkem byl vodík. Vzhledem k tomu, že chlorothiofenová část měla nedostatečnou rozpustnost ve vodě, pokusilo se ji nahradit jinou skupinou, ale bylo to neúspěšné. Chlorothiofenová část se váže na Tyr-228 v dolní části kapsy S1, což z ní činí klíčový faktor, pokud jde o vazbu na FXa. Rivaroxaban má vysokou afinitu i dobrou biologickou dostupnost.
Apixaban
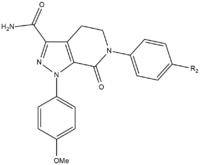
Během vývoje SAR apixabanu bylo třeba testovat tři skupiny, aby bylo dosaženo maximální účinnosti a biologické dostupnosti. První skupinou, kterou bylo třeba testovat, bylo neaktivní místo, protože před testováním SAR je třeba stabilizovat p-methoxyfenylovou skupinu (vazebná část S1). Existuje několik skupin, které zvyšují účinnost sloučeniny, většinou amidy, aminy a tetrazoly, ale také methylsulfonylové a trifluormethylové skupiny. Z těchto skupin má největší vazbu karboxamid a měl podobnou srážecí aktivitu jako sloučeniny
Při testování na psech vykazovala tato sloučenina s karboxamidovou skupinou nazvanou 13F skvělý farmakokinetický profil, nízkou clearance a přiměřený poločas a distribuční objem. Vzhledem k úspěchu při hledání stabilizační skupiny byl výzkum SAR pro vazebnou část S1 (p-methoxyfenyl) ukončen. Ve vazebné skupině S4 se ukázalo, že N-methylacetylová a laktamová analoga mají velmi vysokou vazebnou afinitu k FXa, vykazují velkou srážlivost a selektivitu vůči ostatním proteázám. Ukázalo se, že důležitá je orientace, protože N-methylacetyl měl ve srovnání s acetamidem 300krát nižší vazebnou schopnost na FXa v důsledku nepříznivé planarity v blízkosti vazebného místa v oblasti S4.
SynthesisEdit
RivaroxabanEdit
Rivaroxaban chemicky patří do skupiny n-aryloxazolidinonů. Dalšími léčivými přípravky této skupiny jsou linezolid a tedizolid, které patří mezi antibiotika. V roce 2016 byla publikována syntéza n-aryloxazolidinonů vycházející z ethyl(2,3-dihydroxypropyl)-karbamátu chráněného O-silylem. Karbamát se za mírně bazických podmínek cyklizuje na 2-oxazolidonový kruh a současně dochází k arylizaci oxazolidonového dusíku za katalýzy mědí. Zejména u rivaroxabanu nahrazuje 3-morfolinon jód v poloze p benzenového kruhu měďnatou katalýzou. Poté se odstraní silylová ochranná skupina a vzniklý alkohol se nahradí aminoskupinou, která se pak v posledním kroku acyluje.
Průmyslový přípravek rivaroxabanu byl registrován jako patent společnosti Bayer Healthcare v roce 2005. Vychází z N-(4-aminofenol)-morfolinonu, který je alkylován derivátem propylenoxidu, který rovněž obsahuje primární amin zapojený do ftalimidové ochranné skupiny. Poté se přidá ekvivalent fosgenu za vzniku 2-oxazolidonového kruhu a ftalimid se odstraní. Volný amin lze nyní acylovat, což vede k rivaroxabanu.
Podle patentu má však syntéza „různé nevýhody v řízení reakce, což má nepříznivé účinky zejména pro přípravu“. Patent také vysvětluje jinou syntézu vycházející z chlorothiofenového derivátu, která by byla vhodnější pro průmyslový proces, ale upozorňuje, že z konečného produktu je třeba odstranit toxická rozpouštědla nebo činidla. Proto tento způsob není alternativou.
Byly popsány různé další cesty syntézy rivaroxabanu.
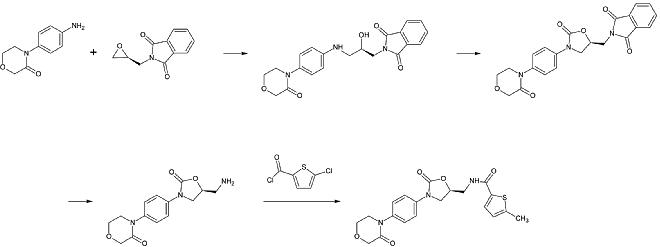
1. krok: Alkylace primárního aromatického aminu
2. krok: Tvorba 2-oxazolinidonového kruhu za použití fosgenového ekvivalentu
3. krok: Odstranění ftalimidové ochranné skupiny
4. krok: Acylace primárního aminu
ApixabanEdit
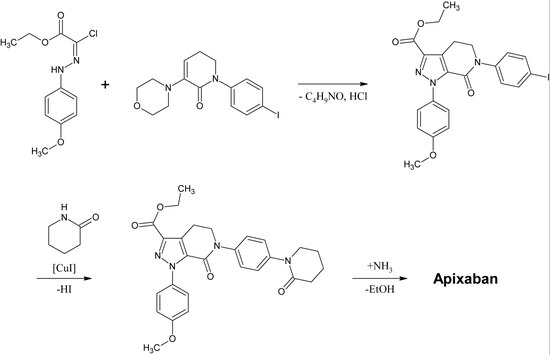
První úplná syntéza apixabanu byla publikována v roce 2007. Klíčovým krokem této reakce je (3+2)cykloadice derivátu p-methoxyfenylchlorohydrazonu a derivátu p-jodofenyl-morfolin-dihydropyridinu. Po následné eliminaci HCl a morfolinu je jód měďnatou katalýzou substituován 2-piperidinonem a ethylester je převeden na amid (aminolýza). Tato reakce byla registrována jako patent v roce 2009.
.