Withaferin A: um potencial agente terapêutico contra a infecção por COVID-19
A nova doença coronavírus 2019 (COVID-19) espalhou-se rapidamente pelo mundo desde que foi relatada pela primeira vez em dezembro de 2019 em Wuhan, China, como uma pneumonia de etiologia desconhecida . A síndrome respiratória aguda grave coronavírus-2 (SRA-CoV-2), denominada pela Organização Mundial de Saúde (OMS), representa a terceira epidemia em larga escala relacionada com os vírus corona. Embora a doença tenha sido notificada pela primeira vez na China, um estudo retrospectivo encontrou subsequentemente evidências de que a SRA-CoV-2 se estava a propagar em França 4 dias antes de ter sido notificada pela primeira vez em Wuhan, China, e 1 mês antes do primeiro caso oficial no país. Desde a sua descoberta inicial, o SRA-CoV-2 espalhou-se por todo o mundo, infectando mais de 11,5 milhões de pessoas e levando à morte de mais de 530.000 pessoas a partir de 6 de Julho de 2020. A gravidade da doença varia muito desde um estado de doença assintomática a doentes com síndrome do desconforto respiratório agudo (SDRA), necessitando de intervenção médica crítica para tentar prevenir a morte dos doentes. Foi subsequentemente descoberto que a enzima conversora de angiotensina 2 (ACE2) é um receptor funcional da proteína SRA-CoV-2 (S-), permitindo a entrada do vírus nas células. ACE2 é um potente regulador negativo do sistema renina-angiotensina (RAS), que é crítico para manter a homeostase do RAS.
O gene ACE2 é composto por 805 aminoácidos e é uma glicoproteína de membrana integral tipo I. ACE2 degrada a angiotensina (Ang)-II, um potente vasoconstritor (que também é pró-inflamatório e promove a fibrose), e a converte em Ang (1-7) . Ang (1-7) é um vasodilatador, que também inibe a proliferação e a apoptose . Além do efeito sistêmico na regulação da pressão arterial, a ACE2 tem efeitos regulatórios locais nas alterações patológicas de vários órgãos, incluindo o coração, os rins e os pulmões . A ACE2 é altamente expressa em células alveolares pulmonares, fornecendo o principal local de entrada do vírus no hospedeiro humano . Além da expressão do ACE2 nas células alveolares pulmonares, ele também é expresso em vários tecidos, inclusive: o sistema vascular (células endoteliais, células angiogênicas migratórias e células musculares lisas vasculares), coração (cardiofibroblastos, cardiomiócitos, células endoteliais, pericócitos e células adiposas epicárdicas) e rins (células endoteliais glomerulares, podócitos e células epiteliais do túbulo proximal), fígado (colangiócitos e hepatócitos), retina (células epiteliais pigmentadas, células fotoreceptoras de haste e cone e células gliais de Müller), enterócitos do intestino, órgãos circunventriculares do sistema nervoso central e vias aéreas superiores (taça e células epiteliais ciliadas) .
Existem duas subunidades da proteína SRA-CoV-2 S: a subunidade S1 tem um domínio de ligação do receptor que se envolve com o receptor de células hospedeiras ACE2, e a subunidade S2 está envolvida na regulação da fusão entre a membrana viral e a membrana hospedeira . Tem sido relatado que o SRA-CoV-2 tem uma afinidade dez vezes maior com o ACE2 em comparação com o SRA-CoV, o que é consistente com a maior eficiência de infecção do SRA-CoV-2 . Embora não tenha sido actualmente encontrada cura, estão a ser realizados vários ensaios clínicos para determinar qual o regime de tratamento mais eficaz para a SRA-CoV-19, com uma extensa lista de potenciais terapias detalhadas numa revisão feita por Gosain et al. . Atualmente, o tratamento do paciente envolve tratamento de apoio e medidas para prevenir uma maior propagação do vírus . Apesar das diferenças nas características da população de pacientes entre a Europa e a China, dois dos principais determinantes do risco de mortalidade dos pacientes que foram encontrados em ambos os grupos são a idade e a presença de condições comorbitárias subjacentes. Uma dessas condições subjacentes associadas a um aumento da mortalidade dos doentes com COVID-19 é a presença de cancro .
Doentes com cancro e a epidemia de COVID-19
Devido ao seu estado potencialmente imuno-comprometido, o tratamento adequado dos doentes com cancro é um problema real e grave que os oncologistas estão a enfrentar, independentemente de o doente estar a experimentar uma infecção por SRA-CoV-2 . Dados de quatro pontos quentes da SRA-CoV-2 (Estados Unidos, Itália, Espanha e China) mostraram que os doentes com cancro infectados com o novo vírus corona têm um risco significativamente maior de admissão numa unidade de cuidados intensivos (UCI) e/ou necessitam de ventilação mecânica, bem como um aumento da mortalidade dos doentes. Em um estudo retrospectivo, a taxa de mortalidade de pacientes com câncer na China infectados pela COVID-19 foi de aproximadamente 28%, em comparação com a taxa global de mortalidade sintomática de 1,4% ou a taxa de mortalidade bruta de 4,5% na China. Talvez sem surpresa, a taxa de mortalidade dos doentes com cancro do pulmão com SRA-CoV-2 tem sido bastante negativa, com um estudo de coorte de Nova Iorque a apresentar uma taxa de mortalidade de 55%. Os doentes com cancro e os seus oncologistas enfrentam actualmente o dilema de saber se o doente deve ou não iniciar ou continuar a terapia para o seu estado de doença primária devido aos riscos associados de contrair o SRA-CoV-2 e à redução dos recursos disponíveis para os profissionais de saúde . A informação sobre a etiologia específica do cancro é escassa em vários estudos sobre o SRA-CoV-2. No entanto, cancros pulmonares, mamários, gastrointestinais e hematológicos (ex. linfoma) têm sido relatados dentro dos estudos de coorte da COVID-19 nos Estados Unidos, Itália e China. Além disso, pacientes com câncer cervical e pacientes com outras neoplasias ginecológicas não especificadas foram relatadas nestes estudos .
Embora fontes selecionadas da literatura forneçam vislumbres dos paradigmas oncológicos exibidos, a já pequena população de pacientes avaliados diminui ainda mais quando estratificada pela tipagem oncológica. Esta é uma limitação substancial para avaliar o risco de mortalidade e fornecer diretrizes para o manejo de pacientes com câncer COVID-19-positivo. Na mesma linha, sabe-se muito pouco sobre a infecção pela COVID-19 em pacientes com câncer de ovário. No momento de escrever, há 22 artigos da PubMed sobre o assunto, dos quais 20 discutem possíveis mudanças ou desafios enfrentados pelas clínicas de câncer para melhor atender as pacientes com câncer de ovário. Os dois restantes artigos discutem um total de três pacientes com câncer de ovário e como o seu tratamento foi modificado devido à atual pandemia. Apenas duas das três pacientes com câncer de ovário foram consideradas positivas para o novo coronavírus, necessitando de tratamento adjuvante com plaquetas devido ao desenvolvimento de trombocitopenia relacionada à quimioterapia. O restante doente com cancro dos ovários discutido testou negativo para a infecção pelo SRA-CoV-2, mas foi considerado positivo com base nos sintomas e achados clínicos do doente (ex. achados anormais da TAC consistente com pneumonia em doentes com COVID-19) . O regimento de cancro deste doente foi adiado até à resolução da pneumonia atípica que apresentava, mas de resto não recebeu qualquer terapia adjuvante. Atualmente, não existem diretrizes globalmente aceitas para o tratamento de pacientes com câncer nos cenários de uma pandemia, devido à falta de dados disponíveis. Recentemente, uma colaboração internacional propôs uma série de abordagens práticas para o diagnóstico e tratamento de pacientes com câncer . Contudo, até que mais informações ou um regime terapêutico eficaz contra a SRA-CoV-2 estejam disponíveis, os doentes com cancro continuarão a apresentar um risco muito elevado de mortalidade devido à epidemia de COVID-19 .
Withaferin a como tratamento prospectivo
Withaferin A (WFA) é uma lactona esteróide isolada da planta Withania somnifera, também conhecida como Ashwagandha . É conhecida por suas propriedades anti-inflamatórias, bem como por suas propriedades anti-tumorigênicas. Trabalhos recentes demonstraram que as infecções por COVID-19 têm um grande componente imunológico e podem resultar no desenvolvimento de uma tempestade de citocinas, uma reação imunológica potencialmente fatal na qual o corpo libera muitas citocinas no sangue em uma taxa rápida. Trabalhos de nosso laboratório demonstraram que o WFA é capaz de reduzir a secreção de várias citocinas pró-inflamatórias (ex. TNFα, IL-6, IL-8, e IL-18) em um modelo metastático de câncer ovariano . Está dentro da possibilidade de que o tratamento com AFA possa ab-rogar a intensidade da tempestade de citocinas devido às propriedades anti-inflamatórias relatadas. Curiosamente, pelo menos três grupos de pesquisa independentes sugeriram que fitoquímicos encontrados na planta Withania somnifera poderiam ser desenvolvidos como agente terapêutico contra a infecção por COVID-19 usando abordagens de acoplamento molecular . Dois dos grupos relataram que vários Withanolides, como o WFA, deveriam ser capazes de se ligar ao domínio de ligação do receptor viral de proteína S, bloqueando ou reduzindo assim as interações com o receptor hospedeiro ACE2 . O terceiro grupo relatou que o WFA e um comanolida separado, Withanone, estão previstos a interagir com a protease principal da SRA-CoV-2, embora se preveja que o WFA tenha menos afinidade de ligação do que um inibidor de protease N3 estabelecido utilizado para os escores de acoplamento de base .
Num estudo não relacionado, o nosso grupo tem investigado o WFA como uma terapêutica potencial para o tratamento do cancro, incluindo o alvo das células estaminais cancerígenas e da caquexia induzida pelo cancro (um distúrbio de desgaste muscular). Como a sinalização de Ang-II é um conhecido mediador da atrofia do músculo esquelético, investigamos o efeito do AFA na sinalização de Ang-II no que diz respeito à caquexia. Dados (em publicação) de nosso laboratório indicaram que o tratamento com AFA pode reduzir os níveis circulantes de Angiotensina II em um modelo experimental de caquexia induzida por câncer. Neste estudo, nós xenografamos a linha de células cancerosas dos ovários A2780 (8,0 × 105 células de baixa passagem ressuspendidas em 100 μl PBS estéril) intraperitonealmente em ratos NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557) fêmeas de 5 a 6 semanas de idade. Os controles sem tumores receberam uma injeção i.p. equivalente de soro fisiológico estéril. Após um período de 8 dias de refractário para permitir a gravação das células cancerosas dos ovários, os animais livres de tumores e portadores de tumores receberam injecções i.p. de WFA (2 mg/kg) ou veículo (10% de sulfóxido de dimetilo, 90% de trioctanoato de glicerol) uma vez a cada 3 dias durante o período de 4 semanas (pós-enxenogestão).
Usando primers qPCR e genes específicos, verificamos que o tratamento com AFA reduziu a expressão relativa do mRNA do AT1R (Receptor Angiotensina II Tipo 1) em comparação com o grupo tratado com veículo em amostras tumorais como determinado por uma análise de variância bidirecional (ANOVA), seguida pela análise pós-hoctualizada do teste de comparação múltipla de Tukey. Com base em nossos achados e nos estudos de acoplamento molecular relatados independentemente, investigamos se o tratamento com AFA alteraria ou não a expressão da ACE2 nos pulmões sob condições livres de tumor e portadoras de tumor. Curiosamente, não encontramos diferenças significativas (valores de p> 0,80 para todas as comparações) na expressão relativa do mRNA da ACE2 em resposta ao tratamento com AFA, conforme determinado por uma ANOVA bidirecional (Fig. 1). Como não observamos diferenças significativas na expressão do mRNA da ACE2 nos pulmões via qPCR, uma das regiões primárias onde a ACE2 é expressa, não investigamos a expressão da ACE2 em outros órgãos. Contudo, foi recentemente relatado que, como subproduto da infecção pela SRA-CoV-2, a expressão da ACE2 é diminuída como parte do processo da doença, o que por sua vez facilita o desenvolvimento de danos multiorganismos. Devido a este efeito, outros sugeriram que bloquear a ligação da SRA-CoV-2 ao receptor ACE2 pode ser uma estratégia mais benéfica para combater o vírus do que aumentar a expressão da ACE2, devido ao seu efeito antagónico na sinalização do AT1R . Em linha com esta lógica, está dentro da possibilidade de que o AFA possa bloquear ou impedir a COVID-19 através de interações com a proteína S viral baseada nos estudos de acoplamento molecular, sem afetar a expressão da ACE2 (como relatado em nossos dados) levando a um agravamento do estado patológico.
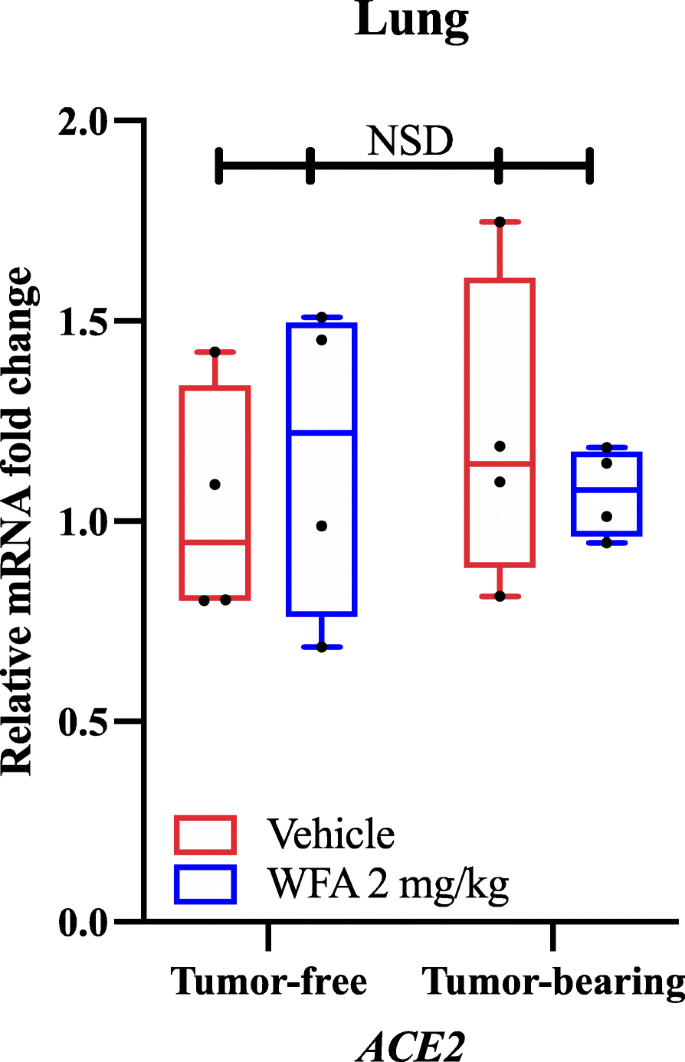
Efeito da palavra A na expressão do mRNA da ACE2. (A) Níveis relativos de mRNA de ACE2 em amostras de pulmões de ratos NSG fêmeas portadores de tumor de ovário e A2780 tratados com veículo ou WFA (2 mg/kg). N = 4-5 camundongos por grupo. Os círculos negros indicam pontos de dados individuais. NSD = Sem diferenças significativas