9.4: Perché non possiamo vedere le molecole?
Il modo più diretto per determinare le strutture delle molecole sarebbe quello di “vedere” come sono disposti i nuclei e come sono distribuiti gli elettroni. Questo non è possibile con la luce visibile, perché le lunghezze d’onda della luce visibile sono molto più lunghe delle dimensioni molecolari abituali. Un fascio di elettroni può avere le lunghezze d’onda corte richieste, ma le piccole molecole organiche vengono distrutte rapidamente dall’irradiazione con elettroni della lunghezza d’onda appropriata. Ciononostante, la microscopia elettronica è una tecnica preziosa per lo studio di grandi molecole, come il DNA, che possono essere colorate con atomi di metalli pesanti prima della visualizzazione, o sono esse stesse ragionevolmente stabili ad un fascio di elettroni (Figure 9-4 e 9-5).

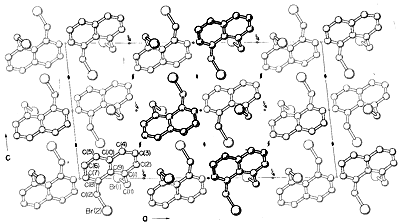
Virtualmente tutte le parti dello spettro della radiazione elettromagnetica, dai raggi x alle onde radio, hanno qualche applicazione pratica per lo studio delle molecole organiche. L’uso della diffrazione dei raggi X per la determinazione delle strutture delle molecole nei cristalli è di particolare valore, e negli ultimi dieci anni questa tecnica è diventata quasi di routine. La figura 9-6 mostra la disposizione dettagliata dei carboni, idrogeni e bromo nell’1,8-bis(bromometil)naftalene, \(1\), come determinato dalla diffrazione dei raggi X. L’apparecchiatura e le tecniche usate sono molto complesse e non sono ancora disponibili per molti laboratori organici.\(^3\)
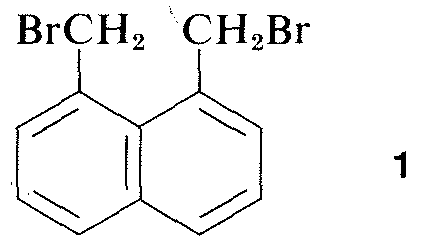
Altri metodi di diffrazione includono la diffrazione di elettroni, che può essere usata per determinare le strutture di gas o di sostanze liquide volatili che non possono essere ottenute come cristalli adatti alla diffrazione di raggi X, e la diffrazione di neutroni, che ha un’applicazione speciale per cristalli in cui si desidera l’esatta posizione degli idrogeni. L’idrogeno non ha un potere di dispersione sufficiente per localizzare con precisione i raggi x tramite la diffrazione dei raggi x.
I metodi di diffrazione possono essere usati per determinare strutture complete di molecole organiche, ma non sono abbastanza di routine per essere utilizzati generalmente nel lavoro pratico di laboratorio organico. Per questo motivo, nel resto di questo capitolo sottolineeremo quelle forme di spettroscopia che sono generalmente disponibili per l’uso di routine in laboratorio. Come si vedrà, questi metodi sono usati dai chimici organici in modi più o meno empirici. In generale, i metodi spettroscopici dipendono da una qualche forma di eccitazione delle molecole attraverso l’assorbimento della radiazione elettromagnetica e, come abbiamo detto, praticamente tutte le parti dello spettro elettromagnetico hanno utilità in questo senso. L’arco comunemente usato dello spettro elettromagnetico è mostrato nella Figura 9-7 insieme a un confronto delle varie unità che sono impiegate per esprimere l’energia o la lunghezza d’onda.
I principali tipi di spettroscopia usati per l’analisi strutturale dei composti organici sono elencati nella Tabella 9-1. La gamma di frequenze della radiazione assorbita è mostrata, così come l’effetto prodotto dalla radiazione e il tipo specifico di informazione che viene utilizzata nell’analisi strutturale. Dopo un breve resoconto dei principi della spettroscopia, descriveremo i metodi che sono di maggiore utilità per il lavoro pratico di laboratorio. Tuttavia, è molto importante essere consapevoli degli altri metodi, meno di routine, che possono essere utilizzati per risolvere problemi speciali, e alcuni di questi sono discussi in questo capitolo e nei capitoli 19 e 27.
Potreste avere problemi con le relazioni tra la varietà di unità di lunghezza d’onda e frequenza comunemente usate in spettroscopia. La relazione tra lunghezza d’onda, frequenza e velocità dovrebbe diventarvi chiara considerandovi in piedi su un molo a guardare le onde dell’oceano che passano. Supponendo che le onde siano uniformemente spaziate, ci sarà una distanza uniforme tra le creste, che è \(\lambda\), la lunghezza d’onda. Le creste dell’onda passeranno ad un certo numero al minuto, che è \(\nu\), la frequenza. La velocità, \(c\), alla quale le creste passano è legata a \(\lambda\) e \(\nu\) dalla relazione \(c = \lambda \nu\).
Questo non è davvero molto complicato e si applica altrettanto bene alle onde dell’acqua o alla radiazione elettromagnetica. Ciò che è quasi inutilmente complicato è la varietà di unità comunemente usate per esprimere \(\lambda\) e \nu\ per la radiazione elettromagnetica. Un problema è la tradizione, l’altro è il desiderio di evitare numeri molto grandi o molto piccoli. Così, come mostra la figura 9-7, possiamo essere interessati a lunghezze d’onda elettromagnetiche che differiscono anche di un fattore di \(10^{16}}. Poiché la velocità della radiazione elettromagnetica nel vuoto è costante a \(3 volte 10^8 \: \text{m sec}^{-1}}), le frequenze differiranno dello stesso fattore.
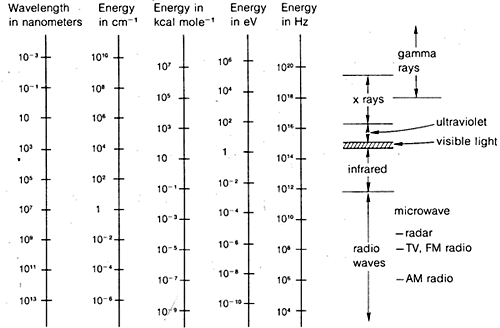
Le unità comunemente usate per la lunghezza d’onda sono metri (\testo{m}), centimetri (\testo{cm}), nanometri (\testo{nm}) e micron (\mu\). In passato, anche gli angstrom (\(Å)) e i millimicron (\(\text{m} \mu m\)) erano usati piuttosto ampiamente.
Tabella 9-1: Principali tecniche spettroscopiche attualmente in uso per l’analisi della struttura molecolare

- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, seconda edizione. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Questo contenuto è protetto da copyright alle seguenti condizioni: “È concesso il permesso per la riproduzione individuale, educativa, di ricerca e non commerciale, la distribuzione, la visualizzazione e l’esecuzione di questo lavoro in qualsiasi formato.”