Withaferin A: egy potenciális terápiás szer a COVID-19 fertőzés ellen
A 2019-es új coronavírus betegség (COVID-19) gyorsan terjedt az egész világon, mivel először 2019 decemberében jelentették a kínai Wuhanban, ismeretlen etiológiájú tüdőgyulladásként . Az Egészségügyi Világszervezet (WHO) által súlyos akut légzőszervi szindróma koronavírus-2 (SARS-CoV-2) elnevezésű betegség a harmadik nagyszabású, koronavírusokkal kapcsolatos járvány . Bár a betegséget először Kínában jelentették, egy retrospektív tanulmány utólag bizonyítékot talált arra, hogy a SARS-CoV-2 4 nappal azelőtt terjedt Franciaországban, hogy először jelentették volna a kínai Wuhanban, és 1 hónappal az első hivatalos esetet az országban . Az első felfedezése óta a SARS-CoV-2 világszerte elterjedt, és 2020. július 6-ig több mint 11,5 millió embert fertőzött meg, és több mint 530 000 ember halálához vezetett . A betegség súlyossága széles skálán mozog a tünetmentes betegségállapottól az akut légzési distressz szindrómát (ARDS) mutató betegekig, ami kritikus orvosi beavatkozást tesz szükségessé a beteg halálának megakadályozására tett kísérlet érdekében . Később felfedezték, hogy az angiotenzin-konvertáló enzim 2 (ACE2) a SARS-CoV-2 spike (S-) fehérje funkcionális receptora, amely lehetővé teszi a vírus bejutását a sejtekbe. Az ACE2 a renin-angiotenzin rendszer (RAS) hatékony negatív szabályozója, amely kritikus fontosságú a RAS homeosztázisának fenntartásában.
Az ACE2 gén 805 aminosavból áll, és egy I. típusú integrál membrán glikoprotein. Az ACE2 lebontja az angiotenzin (Ang)-II-t, egy erős vazokonstriktor (amely egyben pro-inflammatorikus és elősegíti a fibrózist), és Ang(1-7)-vé alakítja át. Az Ang (1-7) egy értágító, amely gátolja a proliferációt és az apoptózist is. A vérnyomás szabályozására gyakorolt szisztémás hatása mellett az ACE2-nek helyi szabályozó hatása van több szerv, köztük a szív, a vese és a tüdő kóros elváltozásaiban . Az ACE2 nagymértékben expresszálódik a tüdő alveoláris sejtjeiben, ami a vírus fő belépési helyét biztosítja az emberi gazdaszervezetbe . Az ACE2 tüdőalveoláris sejtekben történő expressziója mellett különböző szövetekben is kifejeződik, többek között: Az ACE 2.2.1.1.1.1. Az ACE 2.2.2.2. az érrendszerben (endotélsejtek, vándorló angiogén sejtek és érrendszeri simaizomsejtek), a szívben (kardiofibroblasztok, kardiomiociták, endotélsejtek, periciták és epikardiális zsírsejtek) és a vesében (glomeruláris endotélsejtek, podociták és proximális tubulus epitélsejtek), máj (cholangiociták és hepatociták), retina (pigmentált hámsejtek, pálcika- és kúp-fotoreceptorsejtek és Müller-gliasejtek), a belek enterocitái, a központi idegrendszer circumventricularis szervei és a felső légutak (goblet- és csillóhámsejtek) .
A SARS-CoV-2 S-fehérjének két alegysége van: az S1 alegységnek van egy receptorkötő doménje, amely a gazdasejt ACE2 receptorához kapcsolódik, az S2 alegység pedig a vírus és a gazdasejt membránja közötti fúzió szabályozásában vesz részt . Arról számoltak be, hogy a SARS-CoV-2 tízszer nagyobb affinitással rendelkezik az ACE2-hez, mint a SARS-CoV, ami összhangban van a SARS-CoV-2 nagyobb fertőzési hatékonyságával . Bár jelenleg nem találtak gyógymódot, számos klinikai vizsgálatot végeznek annak megállapítására, hogy mi a COVID-19 leghatékonyabb kezelési módja, a lehetséges terápiák részletes listáját Gosain és munkatársai áttekintése tartalmazza. Jelenleg a betegek kezelése támogató kezelést és a vírus további terjedését megakadályozó intézkedéseket foglal magában. Az európai és a kínai betegpopuláció jellemzői közötti különbségek ellenére a betegek halálozási kockázatának két fő meghatározó tényezője, amelyet mindkét csoportban találtak, az életkor és a társbetegségek jelenléte . Az egyik ilyen alapbetegség, amely a COVID-19 betegek halálozásának növekedésével jár, a rákos megbetegedés jelenléte .
Rákos betegek és a COVID-19 járvány
A potenciálisan immunhiányos állapotuk miatt a rákos betegek megfelelő kezelése valós és komoly problémát jelent az onkológusok számára, függetlenül attól, hogy a beteg SARS-CoV-2 fertőzésen esik-e át . Négy SARS-CoV-2 gócpontból (Egyesült Államok, Olaszország, Spanyolország és Kína) származó adatok azt mutatták, hogy az új koronavírussal fertőzött rákbetegeknél jelentősen megnövekedett az intenzív osztályra való felvétel és/vagy a gépi lélegeztetés szükségessége, valamint a beteghalandóság növekedése . Egy retrospektív tanulmányban a COVID-19 vírussal fertőzött kínai rákbetegek halálozási aránya megközelítőleg 28%-osnak bizonyult, szemben az 1,4%-os általános tüneti halálozási aránnyal vagy a 4,5%-os nyers halálozási aránnyal Kínában . Talán nem meglepő módon a SARS-CoV-2-vel fertőzött tüdőrákos betegek halálozási aránya meglehetősen komor, egy New York-i kohorszvizsgálat 55%-os halálozási arányt mutatott ki. A rákbetegek és onkológusaik jelenleg azzal a dilemmával szembesülnek, hogy a SARS-CoV-2 fertőzéssel kapcsolatos kockázatok és az egészségügyi dolgozók rendelkezésére álló erőforrások csökkenése miatt a betegnek el kell-e kezdenie vagy folytatnia kell-e a terápiát elsődleges betegségállapotára . A rák specifikus etiológiájára vonatkozó információ számos SARS-CoV-2 tanulmányon belül kevés. Az Egyesült Államokban , Olaszországban és Kínában végzett COVID-19 kohorszvizsgálatok során azonban tüdő-, emlő-, gyomor-bélrendszeri és hematológiai rákos megbetegedésekről (pl. limfóma) számoltak be. Továbbá méhnyakrákos betegekről és más, nem meghatározott nőgyógyászati rosszindulatú daganatos megbetegedésekről is beszámoltak ezekben a tanulmányokban .
Míg a kiválasztott irodalmi források bepillantást engednek a bemutatott onkológiai paradigmákba, a már így is kis betegpopuláció még tovább csökken, ha onkológiai típusok szerint rétegezzük. Ez jelentős korlátot jelent a halálozási kockázat felmérése és a COVID-19-pozitív daganatos betegek kezelésére vonatkozó irányelvek megadása szempontjából. Hasonló módon nagyon keveset tudunk a petefészekrákos betegek COVID-19-fertőzéséről. A cikk megírásának időpontjában 22 PubMed-cikk foglalkozik a témával, amelyek közül 20 a petefészekrákos betegek jobb ellátása érdekében a rákklinikák lehetséges változtatásait vagy a velük szemben álló kihívásokat tárgyalja. A fennmaradó két cikk összesen három petefészekrákos beteget tárgyal, és azt, hogy kezelésüket hogyan módosították a jelenlegi járvány miatt . A három petefészekrákos beteg közül csak kettő bizonyult pozitívnak az új koronavírusra, és a kemoterápiával összefüggő trombocitopénia kialakulása miatt trombocita adjuváns kezelést igényelt . A fennmaradó petefészekrákos betegnél a SARS-CoV-2 fertőzésre vonatkozó teszt negatív volt, de a beteg tünetei és klinikai leletei alapján (pl. a COVID-19 betegeknél a tüdőgyulladásnak megfelelő rendellenes CT-felvételek) pozitívnak feltételezték . Ennek a betegnek a daganatos kezelését a jelenlévő atípusos tüdőgyulladás megszűnéséig elhalasztották, de egyébként nem kapott semmilyen adjuváns terápiát . Jelenleg a rendelkezésre álló adatok hiánya miatt nincsenek világszerte elfogadott iránymutatások a rákos betegek kezelésére a világjárvány körülményei között . A közelmúltban egy nemzetközi együttműködés egy sor gyakorlati megközelítést javasolt a rákos betegek diagnosztizálására és kezelésére . Amíg azonban nem áll rendelkezésre több információ vagy hatékony terápiás kezelés a SARS-CoV-2 ellen, a rákos betegek továbbra is nagyon magas halálozási kockázatnak lesznek kitéve a COVID-19 járvány miatt .
A withaferin a mint prospektív kezelés
A withaferin A (WFA) egy szteroid lakton, amelyet a Withania somnifera, más néven Ashwagandha növényből izoláltak . Ismert gyulladáscsökkentő tulajdonságairól, valamint tumorellenes tulajdonságairól . A közelmúltban végzett munkák kimutatták, hogy a COVID-19 fertőzések nagy immunkomponenssel rendelkeznek, és citokinvihar kialakulásához vezethetnek, amely egy potenciálisan életveszélyes immunreakció, amelyben a szervezet túl sok citokint bocsát ki a vérbe gyors ütemben . A laboratóriumunkban végzett munka kimutatta, hogy a WFA képes csökkenteni a különböző proinflammatorikus citokinek (pl. TNFα, IL-6, IL-8 és IL-18) szekrécióját a petefészekrák metasztatikus modelljében . Lehetséges, hogy a WFA-kezelés a bejelentett gyulladáscsökkentő tulajdonságai miatt képes megszüntetni a citokinvihar intenzitását. Érdekes módon legalább három független kutatócsoport javasolta, hogy a Withania somnifera növényben található fitokemikáliákat molekuláris dokkolási megközelítések alkalmazásával terápiás szerként lehetne kifejleszteni a COVID-19 fertőzés ellen . Két csoport arról számolt be, hogy a különböző Withanolidok, mint például a WFA, képesek lennének a vírus S-fehérje receptorkötő doménjéhez kötődni, ezáltal blokkolva vagy csökkentve a gazdaszervezet ACE2 receptorával való kölcsönhatást . A harmadik csoport arról számolt be, hogy a WFA és egy másik withanolid, a Withanone az előrejelzések szerint kölcsönhatásba lép a SARS-CoV-2 fő proteázával, bár a WFA-nak az előrejelzések szerint kisebb a kötési affinitása, mint az alapdokkolási pontszámokhoz használt ismert N3 proteázgátlónak .
Egy másik, nem kapcsolódó tanulmányban a csoportunk a WFA-t mint a rák kezelésére szolgáló potenciális terápiát vizsgálta, beleértve a rákos őssejtek és a rák okozta kachexia (izomsorvadási rendellenesség) célzott kezelését. Mivel az Ang-II jelátvitel a vázizomsorvadás ismert közvetítője, megvizsgáltuk a WFA hatását az Ang-II jelátvitelre a kachexia vonatkozásában. A laboratóriumunkból származó (publikálás alatt álló) adatok azt mutatták, hogy a WFA-kezelés csökkentheti az Angiotenzin II keringő szintjét a rák okozta kachexia kísérleti modelljében. Ebben a vizsgálatban az A2780 petefészekrák-sejtvonalat (8,0 × 105 alacsony passzázsú sejt 100 μl steril PBS-ben reszuszpendálva) xenograftoltuk intraperitoneálisan 5-6 hetes nőstény NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557) egerekbe. A tumormentes kontrollok ezzel egyenértékű i.p. steril sóoldat injekciót kaptak. A petefészekráksejtek beágyazódását lehetővé tevő 8 napos refrakter időszakot követően a tumormentes és a tumoros állatok 4 héten keresztül (az exenografting után) 3 naponta egyszer i.p. WFA (2 mg/kg) vagy vivőanyag (10% dimetil-szulfoxid, 90% glicerin-trioktanoát) injekciót kaptak.
A qPCR és génspecifikus primerek alkalmazásával megállapítottuk, hogy a WFA-kezelés csökkentette az AT1R (1-es típusú angiotenzin II receptor) relatív mRNS-expresszióját a hordozóval kezelt csoporthoz képest a tumormintákban, amint azt a kétirányú varianciaanalízis (ANOVA), majd a Tukey-féle többszörös összehasonlító teszt post hoc analízise meghatározta. Eredményeink és az egymástól függetlenül közölt molekuláris dokkolási vizsgálatok alapján megvizsgáltuk, hogy a WFA-kezelés megváltoztatja-e az ACE2 expresszióját a tüdőben tumormentes és tumoros körülmények között. Érdekes módon nem találtunk szignifikáns különbségeket (NSD; p-értékek > 0,80 minden összehasonlításnál) az ACE2 relatív mRNS-expressziójában a WFA-kezelés hatására, amint azt a kétirányú ANOVA meghatározta (1. ábra). Mivel qPCR segítségével nem tapasztaltunk szignifikáns különbségeket az ACE2 mRNS-expressziójában a tüdőben, az ACE2 expressziójának egyik elsődleges régiójában, nem vizsgáltuk az ACE2 expresszióját más szervekben. Nemrégiben azonban arról számoltak be, hogy a SARS-CoV-2 fertőzés melléktermékeként a betegség folyamatának részeként csökken az ACE2 expressziója, ami viszont elősegíti a többszervi károsodás kialakulását . E hatás miatt mások azt javasolták, hogy a SARS-CoV-2 ACE2-receptorhoz való kötődésének blokkolása az AT1R jelátvitelre gyakorolt antagonista hatása miatt előnyösebb stratégia lehet a vírus elleni küzdelemben, mint az ACE2-expresszió fokozása . Ezzel a logikával összhangban, a molekuláris dokkolási vizsgálatok alapján a WFA a vírus S-fehérjével való kölcsönhatások révén blokkolhatja vagy akadályozhatja a COVID-19-et anélkül, hogy befolyásolná az ACE2 expresszióját (ahogyan az adatainkban szerepel), ami a kóros állapot romlásához vezetne.
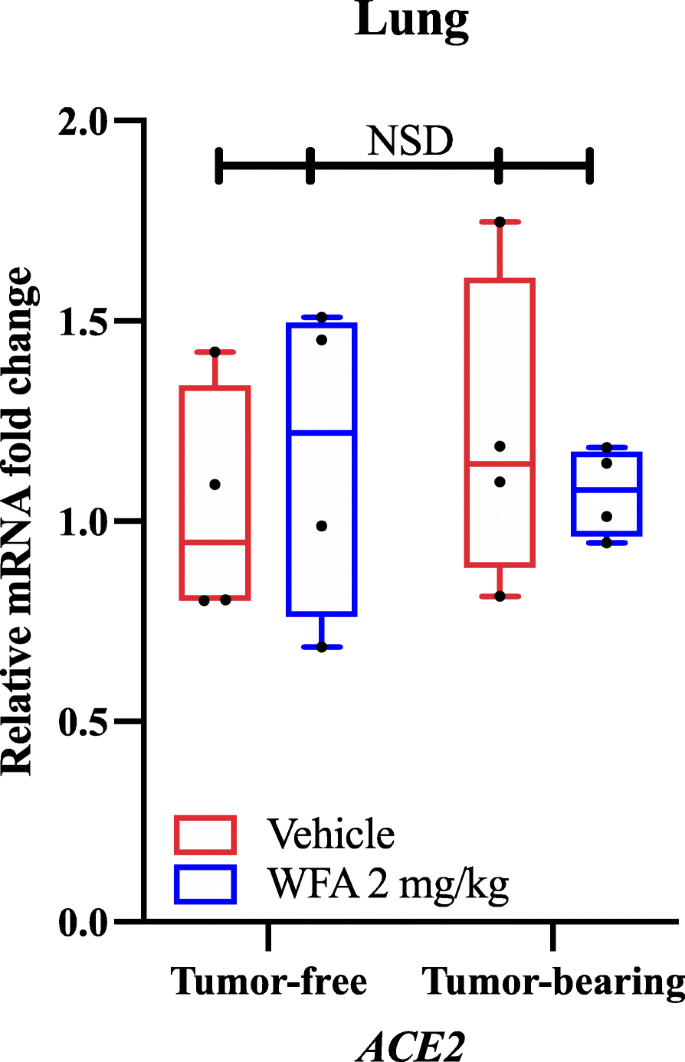
Withaferin A hatása az ACE2 mRNS expressziójára. (A) Az ACE2 relatív mRNS-szintje tumormentes és A2780 petefészekdaganatot hordozó nőstény NSG egerek tumormentes és A2780 petefészekdaganatot hordozó, vivőanyaggal vagy WFA-val (2 mg/kg) kezelt tüdőmintáiban. N = 4-5 egér csoportonként. Fekete körök jelzik az egyes adatpontokat. NSD = Nincs szignifikáns különbség