Withaferin A: ein potenzielles Therapeutikum gegen die COVID-19-Infektion
Die neuartige Coronavirus-Krankheit 2019 (COVID-19) hat sich schnell auf der ganzen Welt verbreitet, seit sie im Dezember 2019 erstmals in Wuhan, China, als Lungenentzündung unbekannter Ätiologie gemeldet wurde. Das schwere akute respiratorische Syndrom Coronavirus-2 (SARS-CoV-2), wie es von der Weltgesundheitsorganisation (WHO) bezeichnet wird, ist die dritte große Epidemie im Zusammenhang mit Coronaviren . Obwohl die Krankheit zuerst in China gemeldet wurde, hat eine retrospektive Studie Hinweise darauf ergeben, dass sich SARS-CoV-2 bereits 4 Tage vor der ersten Meldung in Wuhan, China, und 1 Monat vor dem ersten offiziellen Fall in Frankreich verbreitet hat. Seit seiner ersten Entdeckung hat sich SARS-CoV-2 weltweit ausgebreitet und bis zum 6. Juli 2020 über 11,5 Millionen Menschen infiziert und zum Tod von mehr als 530 000 Menschen geführt. Der Schweregrad der Krankheit reicht von einem asymptomatischen Krankheitszustand bis hin zu Patienten mit akutem Atemnotsyndrom (ARDS), das kritische medizinische Eingriffe erfordert, um den Tod des Patienten zu verhindern. In der Folge wurde entdeckt, dass das Angiotensin-konvertierende Enzym 2 (ACE2) ein funktioneller Rezeptor für das SARS-CoV-2-Spike-(S-)Protein ist, das dem Virus das Eindringen in Zellen ermöglicht. ACE2 ist ein starker negativer Regulator des Renin-Angiotensin-Systems (RAS), der für die Aufrechterhaltung der Homöostase des RAS von entscheidender Bedeutung ist.
Das ACE2-Gen besteht aus 805 Aminosäuren und ist ein integrales Membran-Glykoprotein vom Typ I. ACE2 baut Angiotensin (Ang)-II, einen starken Vasokonstriktor (der auch entzündungsfördernd und fibrosefördernd wirkt), ab und wandelt es in Ang(1-7) um. Ang(1-7) ist ein Vasodilatator, der auch die Proliferation und Apoptose hemmt. Neben der systemischen Wirkung auf die Blutdruckregulierung hat ACE2 lokale regulatorische Wirkungen bei pathologischen Veränderungen in verschiedenen Organen, darunter Herz, Niere und Lunge. ACE2 wird in hohem Maße in Alveolarzellen der Lunge exprimiert, die die Haupteintrittsstelle für das Virus in den menschlichen Wirt darstellen. Neben der Expression von ACE2 in Lungenalveolarzellen wird es auch in verschiedenen Geweben exprimiert, darunter: Gefäßsystem (Endothelzellen, wandernde angiogene Zellen und vaskuläre glatte Muskelzellen), Herz (Kardiofibroblasten, Kardiomyozyten, Endothelzellen, Perizyten und epikardiale Fettzellen) und Nieren (glomeruläre Endothelzellen, Podozyten und Epithelzellen der proximalen Tubuli), Leber (Cholangiozyten und Hepatozyten), Netzhaut (pigmentierte Epithelzellen, Stäbchen- und Zapfen-Photorezeptorzellen und Müller-Gliazellen), Enterozyten des Darms, zirkumventrikuläre Organe des Zentralnervensystems und die oberen Atemwege (Becher- und Flimmerepithelzellen) .
Es gibt zwei Untereinheiten des SARS-CoV-2 S-Proteins: Die S1-Untereinheit hat eine Rezeptorbindungsdomäne, die sich mit dem Wirtszellrezeptor ACE2 verbindet, und die S2-Untereinheit ist an der Regulierung der Fusion zwischen der viralen und der Wirtsmembran beteiligt. Es wurde berichtet, dass SARS-CoV-2 im Vergleich zu SARS-CoV eine zehnmal höhere Affinität zu ACE2 hat, was mit der höheren Effizienz der Infektion von SARS-CoV-2 übereinstimmt. Obwohl es bisher keine Heilung gibt, werden derzeit mehrere klinische Studien durchgeführt, um das wirksamste Behandlungsschema für COVID-19 zu ermitteln; eine umfangreiche Liste potenzieller Therapien ist in einer Übersichtsarbeit von Gosain et al. aufgeführt. Derzeit umfasst die Behandlung der Patienten eine unterstützende Behandlung und Maßnahmen zur Verhinderung einer weiteren Ausbreitung des Virus. Trotz der unterschiedlichen Merkmale der Patientenpopulationen in Europa und China sind zwei der wichtigsten Determinanten für das Sterberisiko der Patienten in beiden Gruppen das Alter und das Vorhandensein von Begleiterkrankungen. Eine solche Grunderkrankung, die mit einem Anstieg der Sterblichkeit von COVID-19-Patienten verbunden ist, ist das Vorhandensein von Krebs.
Krebspatienten und die COVID-19-Epidemie
Die angemessene Behandlung von Krebspatienten ist aufgrund ihres potenziell immungeschwächten Status ein echtes und ernsthaftes Problem, mit dem Onkologen konfrontiert sind, unabhängig davon, ob der Patient an einer SARS-CoV-2-Infektion leidet. Daten aus vier SARS-CoV-2-Hotspots (USA, Italien, Spanien und China) haben gezeigt, dass Krebspatienten, die mit dem neuartigen Coronavirus infiziert sind, ein deutlich erhöhtes Risiko haben, in eine Intensivstation eingewiesen zu werden und/oder mechanisch beatmet werden zu müssen, und dass die Sterblichkeit der Patienten zunimmt. In einer retrospektiven Studie wurde festgestellt, dass die Sterblichkeitsrate bei Krebspatienten in China, die mit COVID-19 infiziert sind, bei etwa 28 % liegt, verglichen mit der allgemeinen symptomatischen Sterblichkeitsrate von 1,4 % oder der rohen Sterblichkeitsrate von 4,5 % in China. Es überrascht vielleicht nicht, dass die Sterblichkeitsrate von Lungenkrebspatienten mit SARS-CoV-2 ziemlich düster ist, wobei eine New Yorker Kohortenstudie eine Sterblichkeitsrate von 55 % ergab. Krebspatienten und ihre Onkologen stehen derzeit vor dem Dilemma, ob der Patient eine Therapie für seine Grunderkrankung beginnen oder fortsetzen soll, da das Risiko einer Ansteckung mit SARS-CoV-2 besteht und die für das Gesundheitspersonal zur Verfügung stehenden Ressourcen begrenzt sind. In mehreren SARS-CoV-2-Studien gibt es kaum Informationen über die spezifische Ätiologie der Krebserkrankung. Im Rahmen von COVID-19-Kohortenstudien in den Vereinigten Staaten, Italien und China wurde jedoch über Lungen-, Brust-, Magen-Darm- und Blutkrebs (z. B. Lymphome) berichtet. Darüber hinaus wurden in diesen Studien auch Patienten mit Gebärmutterhalskrebs und anderen nicht spezifizierten gynäkologischen Malignomen erfasst.
Ausgewählte Literaturquellen geben zwar einen Einblick in die gezeigten onkologischen Paradigmen, doch schrumpft die bereits kleine untersuchte Patientenpopulation noch weiter, wenn man sie nach onkologischer Typisierung stratifiziert. Dies stellt eine erhebliche Einschränkung für die Bewertung des Mortalitätsrisikos und die Erstellung von Leitlinien für die Behandlung von COVID-19-positiven Krebspatienten dar. Auch über die COVID-19-Infektion bei Eierstockkrebspatientinnen ist nur sehr wenig bekannt. Zum Zeitpunkt der Erstellung dieses Artikels gibt es 22 PubMed-Artikel zu diesem Thema, von denen 20 mögliche Änderungen oder Herausforderungen für Krebskliniken zur besseren Versorgung von Eierstockkrebspatientinnen erörtern. In den verbleibenden zwei Artikeln werden insgesamt drei Eierstockkrebspatientinnen beschrieben und wie ihre Behandlung aufgrund der aktuellen Pandemie geändert wurde. Nur bei zwei der drei Eierstockkrebspatientinnen wurde ein positiver Befund für das neuartige Coronavirus festgestellt, so dass aufgrund der Entwicklung einer chemotherapiebedingten Thrombozytopenie eine adjuvante Behandlung mit Blutplättchen erforderlich war. Die verbleibende Patientin mit Eierstockkrebs wurde negativ auf eine SARS-CoV-2-Infektion getestet, aber aufgrund der Symptome der Patientin und der klinischen Befunde (z. B. abnormale CT-Befunde, die mit einer Lungenentzündung bei COVID-19-Patienten übereinstimmen) wurde vermutet, dass sie positiv ist. Die Krebsbehandlung dieser Patientin wurde bis zum Abklingen der atypischen Lungenentzündung aufgeschoben, ansonsten erhielt sie aber keine adjuvante Therapie. Derzeit gibt es keine weltweit anerkannten Leitlinien für die Behandlung von Krebspatienten im Rahmen einer Pandemie, da es an Daten mangelt. Kürzlich hat eine internationale Zusammenarbeit eine Reihe von praktischen Ansätzen für die Diagnose und Behandlung von Krebspatienten vorgeschlagen. Solange jedoch nicht mehr Informationen oder ein wirksames Therapieschema gegen SARS-CoV-2 zur Verfügung stehen, werden Krebspatienten weiterhin einem sehr hohen Sterblichkeitsrisiko aufgrund der COVID-19-Epidemie ausgesetzt sein.
Withaferin A als mögliche Behandlung
Withaferin A (WFA) ist ein steroidales Lakton, das aus der Pflanze Withania somnifera, auch bekannt als Ashwagandha, isoliert wird. Es ist für seine entzündungshemmenden und tumorhemmenden Eigenschaften bekannt. Jüngste Arbeiten haben gezeigt, dass COVID-19-Infektionen eine starke Immunkomponente haben und zur Entwicklung eines Zytokinsturms führen können, einer potenziell lebensbedrohlichen Immunreaktion, bei der der Körper zu viele Zytokine in rascher Folge ins Blut abgibt. Arbeiten aus unserem Labor haben gezeigt, dass WFA in der Lage ist, die Sekretion verschiedener proinflammatorischer Zytokine (z. B. TNFα, IL-6, IL-8 und IL-18) in einem metastatischen Modell von Eierstockkrebs zu verringern. Es liegt im Bereich des Möglichen, dass die Behandlung mit WFA die Intensität des Zytokinsturms aufgrund der berichteten entzündungshemmenden Eigenschaften aufheben kann. Interessanterweise haben mindestens drei unabhängige Forschergruppen vorgeschlagen, dass Phytochemikalien aus der Pflanze Withania somnifera mit Hilfe von Molekular-Docking-Ansätzen als Therapeutikum gegen COVID-19-Infektionen entwickelt werden könnten. Zwei der Gruppen berichteten, dass verschiedene Withanolide, wie z. B. WFA, in der Lage sein sollten, an die Bindungsdomäne des viralen S-Protein-Rezeptors zu binden und dadurch die Wechselwirkungen mit dem ACE2-Rezeptor des Wirts zu blockieren oder zu verringern. Die dritte Gruppe berichtete, dass WFA und ein separates Withanolid, Withanone, mit der Hauptprotease von SARS-CoV-2 interagieren können, obwohl WFA eine geringere Bindungsaffinität als ein etablierter N3-Proteaseinhibitor haben soll, der für die grundlegenden Docking-Scores verwendet wurde.
In einer nicht damit zusammenhängenden Studie hat unsere Gruppe WFA als potenzielles Therapeutikum zur Behandlung von Krebs untersucht, einschließlich der gezielten Behandlung von Krebsstammzellen und krebsbedingter Kachexie (einer Muskelschwunderkrankung). Da die Ang-II-Signalübertragung ein bekannter Vermittler der Skelettmuskelatrophie ist, haben wir die Wirkung von WFA auf die Ang-II-Signalübertragung im Zusammenhang mit Kachexie untersucht. Daten aus unserem Labor, die gerade veröffentlicht werden, haben gezeigt, dass die Behandlung mit WFA die zirkulierenden Angiotensin-II-Spiegel in einem experimentellen Modell der krebsbedingten Kachexie senken kann. In dieser Studie haben wir die Eierstockkrebs-Zelllinie A2780 (8,0 × 105 Zellen in niedriger Passage, resuspendiert in 100 μl sterilem PBS) intraperitoneal in 5 bis 6 Wochen alte weibliche NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557) Mäuse xenotransplantiert. Tumorfreie Kontrolltiere erhielten eine äquivalente i.p.-Injektion von steriler Kochsalzlösung. Nach einer 8-tägigen Refraktärzeit, um die Einnistung der Eierstockkrebszellen zu ermöglichen, erhielten tumorfreie und tumortragende Tiere i.p. Injektionen von WFA (2 mg/kg) oder Vehikel (10 % Dimethylsulfoxid, 90 % Glyceroltrioctanoat) einmal alle 3 Tage über einen Zeitraum von 4 Wochen (nach der Xenotransplantation).
Unter Verwendung von qPCR und gen-spezifischen Primern fanden wir heraus, dass die WFA-Behandlung die relative mRNA-Expression von AT1R (Angiotensin-II-Rezeptor Typ 1) im Vergleich zur mit dem Vehikel behandelten Gruppe in den Tumorproben reduzierte, wie durch eine Zwei-Wege-Varianzanalyse (ANOVA), gefolgt von einer Tukey’s Multiple Comparison Test Post-hoc-Analyse, festgestellt wurde. Auf der Grundlage unserer Ergebnisse und der unabhängig berichteten molekularen Docking-Studien untersuchten wir, ob die WFA-Behandlung die ACE2-Expression in der Lunge unter tumorfreien und tumortragenden Bedingungen verändern würde oder nicht. Interessanterweise fanden wir keine signifikanten Unterschiede (NSD; p-Werte > 0,80 für alle Vergleiche) in der relativen mRNA-Expression von ACE2 als Reaktion auf die WFA-Behandlung, wie durch eine zweiseitige ANOVA ermittelt wurde (Abb. 1). Da wir mittels qPCR keine signifikanten Unterschiede in der mRNA-Expression von ACE2 in der Lunge, einer der primären Regionen, in der ACE2 exprimiert wird, feststellen konnten, haben wir die Expression von ACE2 in anderen Organen nicht untersucht. Kürzlich wurde jedoch berichtet, dass die ACE2-Expression als Nebenprodukt der SARS-CoV-2-Infektion als Teil des Krankheitsprozesses verringert wird, was wiederum die Entwicklung von Multiorganschäden begünstigt. Aufgrund dieses Effekts haben andere vorgeschlagen, dass die Blockierung der Bindung von SARS-CoV-2 an den ACE2-Rezeptor aufgrund seiner antagonistischen Wirkung auf den AT1R-Signalweg eine vorteilhaftere Strategie zur Bekämpfung des Virus sein könnte als die Steigerung der ACE2-Expression. In Übereinstimmung mit dieser Logik liegt es im Bereich des Möglichen, dass WFA COVID-19 durch Wechselwirkungen mit dem viralen S-Protein blockieren oder behindern kann, basierend auf den molekularen Docking-Studien, ohne die ACE2-Expression zu beeinträchtigen (wie in unseren Daten berichtet), was zu einer Verschlimmerung des pathologischen Zustands führt.
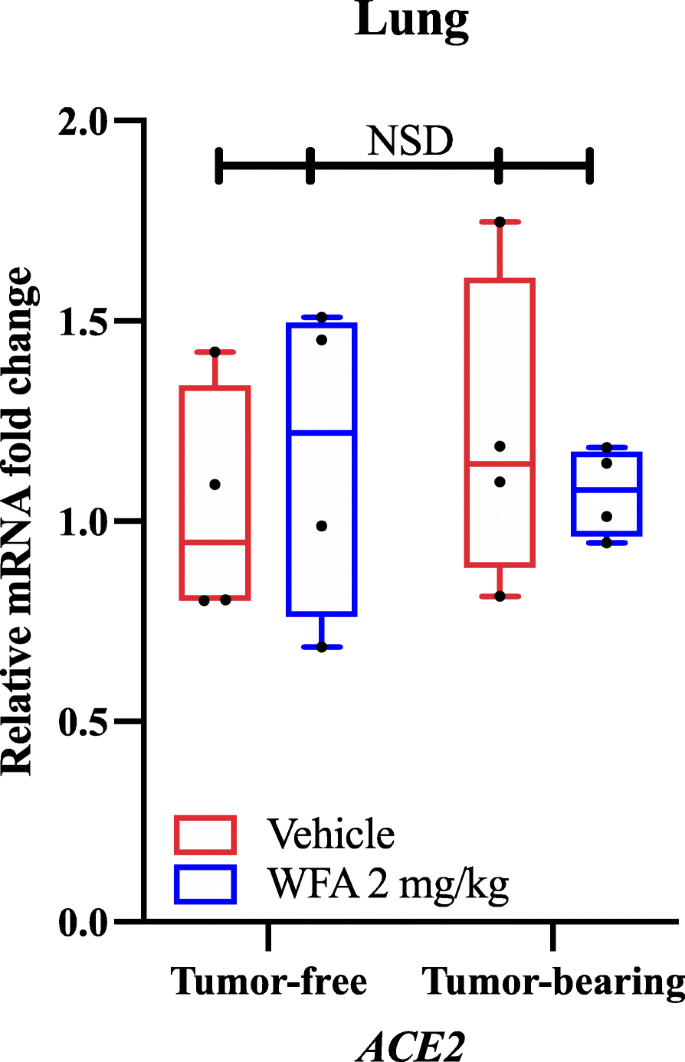
Wirkung von Withaferin A auf die ACE2-mRNA-Expression. (A) Relative mRNA-Spiegel von ACE2 in Lungenproben von tumorfreien und A2780-Ovarialtumor-tragenden weiblichen NSG-Mäusen, die mit Vehikel oder WFA (2 mg/kg) behandelt wurden. N = 4-5 Mäuse pro Gruppe. Schwarze Kreise kennzeichnen einzelne Datenpunkte. NSD = Keine signifikanten Unterschiede