Withaferin A: a potential therapeutic agent against COVID-19 infection
2019年12月に中国武漢内で原因不明の肺炎として初めて報告されてから、急速に世界中に広まっている新規コロナウイルス症2019(COVID-19) … 続きを読む 重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は、世界保健機関(WHO)の呼称で、コロナウイルスに関連する3番目の大規模な流行に相当します. この病気は中国国内で最初に報告されましたが、その後、SARS-CoV-2が中国の武漢で最初に報告される4日前、フランスで最初の公式患者が出る1ヶ月前にフランス国内で広がっていたという証拠が、レトロスペクティブ研究によって発見されました。 SARS-CoV-2は最初の発見以来、世界中に広がり、2020年7月6日現在、1150万人以上が感染し、53万人以上が死亡している。 重症度は、無症状から急性呼吸窮迫症候群(ARDS)を呈する患者まで幅広く、患者の死を防ぐために重要な医療介入が必要です。 その後、アンジオテンシン変換酵素2(ACE2)がSARS-CoV-2スパイク(S-)タンパク質の機能的受容体であり、ウイルスの細胞侵入を可能にすることが発見された。 ACE2は、レニン・アンジオテンシン系(RAS)の強力な負の制御因子であり、RASの恒常性の維持に重要である。
ACE2遺伝子は805アミノ酸からなり、I型膜貫通糖タンパク質である。 ACE2は、強力な血管収縮物質であるアンジオテンシン(Ang)-IIを分解し(炎症促進、線維化促進作用もある)、Ang(1-7)へと変換する。 Ang (1-7)は血管拡張薬であり、増殖やアポトーシスを抑制する。 ACE2 は、血圧調節に対する全身的な作用の他に、心臓、腎臓、肺などいくつかの臓器の病的変化に対する局所的な調節作用も有しています . ACE2 は肺胞細胞で高発現し、ヒト宿主へのウイルスの主要な侵入部位を提供している . 肺胞細胞でのACE2の発現に加え、以下のような様々な組織でも発現している。 血管系(内皮細胞、移動性血管新生細胞、血管平滑筋細胞)、心臓(心線維芽細胞、心筋細胞、内皮細胞、周皮細胞、心外膜脂肪細胞)、腎臓(糸球体内皮細胞、ポドサイト、近位尿細管上皮細胞)。 肝臓(胆管細胞、肝細胞)、網膜(色素上皮細胞、杆体・錐体視細胞、ミュラーグリア細胞)、腸管、中枢神経系周囲器官、上気道(杯上皮細胞、繊毛上皮細胞)…。
SARS-CoV-2のS-proteinには2つのサブユニットがあり、S1サブユニットは宿主細胞の受容体ACE2と結合する受容体結合ドメインを持っており、S2サブユニットはウイルスと宿主膜との融合を制御するのに関与している 。 SARS-CoV-2はSARS-CoVに比べてACE2への親和性が10倍高いことが報告されており、SARS-CoV-2の感染効率の高さと一致している。 現在、治療法は見つかっていないが、COVID-19に対する最も効果的な治療法を決定するためにいくつかの臨床試験が行われており、Gosainらによるレビューでは、可能性のある治療法の広範なリストが詳述されている…。 現在、患者の管理には、支持療法とウイルスのさらなる拡散を防ぐための措置が含まれています。 ヨーロッパと中国では患者集団の特徴が異なるにもかかわらず、両グループで認められた患者の死亡リスクの主な決定要因は、年齢と併存する基礎疾患の存在の2つでした。 COVID-19 患者の死亡率の上昇に関連するそのような基礎疾患の 1 つは、がんの存在です。
Cancer patients and the COVID-19 epidemic
潜在的に免疫が低下している状態のため、患者が SARS-CoV-2 感染を経験しているかどうかにかかわらず、がん患者の適切な治療は、腫瘍医にとって実際に直面している深刻な問題です。 SARS-CoV-2 ホットスポット4カ国(米国、イタリア、スペイン、中国)のデータから、新型コロナウイルスに感染したがん患者は、集中治療室(ICU)への入院や機械換気を必要とするリスクが大幅に上昇し、患者の死亡率も増加することが示されている。 あるレトロスペクティブな研究では、COVID-19 に感染した中国の癌患者の致死率は約 28% であることが判明しました。これは、中国全体の症候性致死率 1.4% または粗死亡率 4.5% と比較しています。 当然のことながら、SARS-CoV-2に感染した肺癌患者の致死率はかなり厳しく、ニューヨークのコホート研究では55%の致死率を示している。 癌患者とその腫瘍医は現在、SARS-CoV-2感染の関連リスクと医療従事者が利用できる資源の減少のため、患者が原疾患の治療を開始または継続すべきかどうかというジレンマに陥っている。 癌の特定の病因に関する情報は、いくつかのSARS-CoV-2研究の中では乏しい。 しかし、米国、イタリア、中国におけるCOVID-19コホート研究において、肺がん、乳がん、消化器がん、血液がん(例:リンパ腫)が報告されている。 さらに、子宮頸がん患者およびその他の特定不能の婦人科悪性腫瘍の患者もこれらの研究で報告されている。
一部の文献ソースから、示された腫瘍学のパラダイムが垣間見えるが、腫瘍学のタイピングで層別すると、すでに評価した患者集団がさらに少なくなる。 これは,死亡リスクを評価し,COVID-19陽性癌患者の管理に関するガイドラインを提供する上で,大きな制約となる。 同様に、卵巣癌患者におけるCOVID-19感染についても、ほとんど知られていない。 本稿執筆時点で、このテーマに関するPubMedの論文は22件あり、そのうち20件は卵巣癌患者への対応を改善するための癌診療所の変更の可能性や直面する課題について論じている。 残りの2つの記事は、合計3人の卵巣がん患者と、彼らの治療が今回のパンデミックによってどのように変更されたかを論じています。 3人の卵巣癌患者のうち2人だけが新型コロナウイルスに陽性であり、化学療法による血小板減少症を発症したため、血小板による補助治療が必要となった。 残りの卵巣癌患者については、SARS-CoV-2感染は陰性であったが、患者の症状や臨床所見(例:COVID-19患者の肺炎と一致するCTスキャン異常)から陽性と推定された。 この患者のがん治療は、異型肺炎が治るまで延期されたが、それ以外は補助療法を受けなかった。 現在、パンデミック時のがん患者管理について、世界的に認められたガイドラインは、データが不足しているため存在しません。 最近、国際的な共同研究により、がん患者の診断と治療に関する一連の実用的なアプローチが提案されました。 しかし、より多くの情報やSARS-CoV-2に対する効果的な治療法が利用可能になるまで、がん患者はCOVID-19の流行による死亡の非常に高いリスクにさらされ続けるでしょう。
Withaferin a as a prospective treatment
Withaferin A (WFA) は植物 Withania somnifera、別名 Ashwagandha から分離したステロイド性ラクトルであり、また、Ashagandhaとしても知られています。 抗炎症作用や抗腫瘍作用が知られています。 最近の研究では、COVID-19感染症には大きな免疫要素があり、サイトカインストーム(体があまりにも多くのサイトカインを急速に血中に放出する、生命を脅かす可能性のある免疫反応)の発症につながる可能性があることが証明されました。 私たちの研究室では、WFAが卵巣癌の転移モデルにおいて、さまざまな炎症性サイトカイン(TNFα、IL-6、IL-8、IL-18など)の分泌を抑えることができることを実証している。 WFAは、その抗炎症作用により、サイトカインストームの強さを抑制することが可能である。 興味深いことに、少なくとも3つの独立した研究グループが、植物Withania somniferaに含まれる植物化学物質が、分子ドッキングアプローチを用いてCOVID-19感染に対する治療薬として開発される可能性を示唆している 。 そのうちの2つのグループは、WFAなどのさまざまなWithanolidesが、ウイルスのSタンパク質受容体結合ドメインに結合し、それによって宿主のACE2受容体との相互作用を遮断または低減できるはずであると報告している。 3 番目のグループは、WFA と別のウィタノライドである Withanone が SARS-CoV-2 の主要なプロテアーゼと相互作用することが予測されると報告しましたが、WFA はベースラインのドッキング スコアに使用される確立した N3 プロテアーゼ阻害剤よりも結合親和性が低いことが予測されました。 Ang-IIシグナルは骨格筋萎縮のメディエーターとして知られているため、WFAがAng-IIシグナルに及ぼす影響を悪液質との関連で検討した。 我々の研究室では、癌誘発性悪液質の実験モデルにおいて、WFA投与がAngiotensin IIの循環レベルを低下させることを示すデータがある(発表中)。 この研究では、卵巣癌細胞株A2780(100μl滅菌PBSに再懸濁した8.0×105低通過細胞)を5〜6週齢の雌NOD.Cg-PrkdcidIl2rgtm1Wjl/SzJ(NSG;Jackson Lab Strain # 005557)マウスに腹腔内で異種移植を行なった。 無腫瘍のコントロールには、滅菌生理食塩水をi.p.注射した。 卵巣癌細胞の移植を可能にするための不応期の8日間後、無腫瘍および腫瘍を有する動物は、4週間の期間にわたって3日に1回、WFA(2mg/kg)またはビヒクル(10%ジメチルスルホキシド、90%グリセロールトリオクタノアート)のi.p注射を受けた(xenografting後)。
qPCRと遺伝子特異的プライマーを用いて、二元配置分散分析(ANOVA)後にTukeyの多重比較検定ポストホック分析により決定したところ、WFA投与は腫瘍サンプルにおけるAT1R(Angiotensin II Receptor Type 1)の相対mRNA発現を車両投与グループと比較して低下させていることが判明しました。 我々の知見と独自に報告された分子ドッキング研究に基づいて、我々はWFA治療が腫瘍のない状態および腫瘍を有する状態の肺におけるACE2発現を変えるか否かを調べた。 興味深いことに、二元配置分散分析により、WFA処理に対するACE2の相対的mRNA発現に有意差は認められなかった(NSD、すべての比較でp値> 0.80)(Fig.1)。 ACE2が発現する主要な部位の1つである肺ではqPCRによるACE2 mRNAの発現に有意差が認められなかったため、他の臓器におけるACE2の発現については調査していない。 しかし、最近、SARS-CoV-2感染の副産物として、病気の過程でACE2の発現が低下し、それが多臓器障害の発生を促進させることが報告された。 この効果により、SARS-CoV-2とACE2受容体の結合を阻害することは、AT1Rシグナル伝達に対する拮抗作用により、ACE2の発現を増強するよりも有益なウイルス対策となる可能性が示唆されている … この理論的根拠に沿って、WFAは、(我々のデータで報告されているように)ACE2の発現に影響を与えることなく、分子ドッキング研究に基づいて、ウイルスのSタンパク質との相互作用を通じてCOVID-19をブロックまたは阻害し、病態を悪化させることができるという可能性の範囲内である。
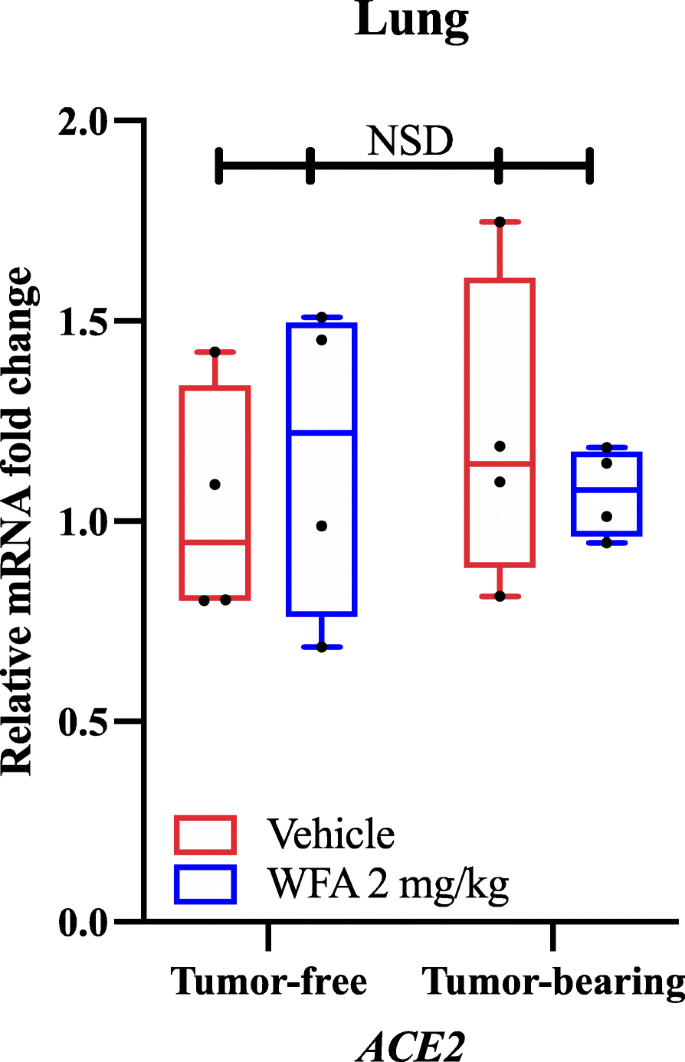
Withaferin AのACE2 mRNA発現への影響。 (A)無腫瘍およびA2780卵巣腫瘍を有する雌NSGマウスにビヒクルまたはWFA(2 mg/kg)を投与した肺サンプルにおけるACE2の相対的mRNAレベル。 N = 4-5マウス/群。 黒丸は個々のデータ点を示す。 NSD = 有意差なし
。