9.4: Miért nem látjuk a molekulákat?
A molekulák szerkezetének meghatározásának legegyszerűbb módja az lenne, ha “látnánk”, hogyan helyezkednek el az atommagok és hogyan oszlanak el az elektronok. Ez a látható fénnyel nem lehetséges, mert a látható fény hullámhossza nagyon sokkal hosszabb, mint a szokásos molekulaméretek. Egy elektronsugár rendelkezhet a szükséges rövid hullámhosszúsággal, de a kis szerves molekulák gyorsan megsemmisülnek a megfelelő hullámhosszúságú elektronokkal való besugárzás hatására. Ennek ellenére az elektronmikroszkópia értékes technika a nagy molekulák, például a DNS vizsgálatára, amelyeket a megtekintés előtt nehézfématomokkal meg lehet festeni, vagy amelyek maguk is meglehetősen stabilak az elektronsugárral szemben (9-4. és 9-5. ábra).

Az elektromágneses sugárzás spektrumának szinte minden része, a röntgensugaraktól a rádióhullámokig, valamilyen gyakorlati alkalmazással bír a szerves molekulák tanulmányozására. A röntgendiffrakció alkalmazása a kristályokban lévő molekulák szerkezetének meghatározására különösen értékes, és az elmúlt tíz évben ez a technika szinte rutinszerűvé vált. A 9-6. ábra az 1,8-bisz(bróm-metil)naftalin, \(1\) szénatomjainak, hidrogénjeinek és brómjainak röntgendiffrakcióval meghatározott részletes elrendezését mutatja. Az alkalmazott készülék és technika rendkívül bonyolult, és még nem sok szerves laboratórium számára áll rendelkezésre.\(^3\)
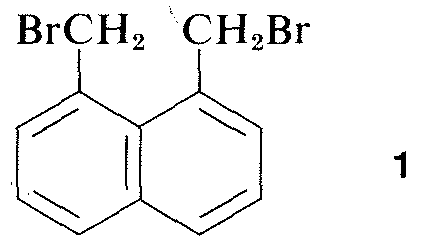
Az egyéb diffrakciós módszerek közé tartozik az elektrondiffrakció, amely olyan gázok vagy illékony folyékony anyagok szerkezetének meghatározására használható, amelyek nem kaphatók röntgendiffrakcióra alkalmas kristályokként, valamint a neutrondiffrakció, amely különösen olyan kristályok esetében alkalmazható, amelyekben a hidrogének pontos elhelyezkedésére van szükség. A hidrogén nem rendelkezik elegendő szórási erővel ahhoz, hogy a röntgendiffrakcióval pontosan lokalizálható legyen.
A diffrakciós módszerek felhasználhatók szerves molekulák teljes szerkezetének meghatározására, de nem eléggé rutinszerűek ahhoz, hogy a gyakorlati szerves laboratóriumi munkában általában alkalmazzák őket. Emiatt a fejezet további részében a spektroszkópiának azokat a formáit emeljük ki, amelyek általában rendelkezésre állnak a rutin laboratóriumi használatra. Mint látni fogjuk, ezeket a módszereket a szerves kémikusok többé-kevésbé empirikus módon használják. Általában véve a spektroszkópiai módszerek a molekulák elektromágneses sugárzás elnyelésével történő gerjesztésének valamilyen formáján alapulnak, és mint már említettük, az elektromágneses spektrum gyakorlatilag minden része hasznosítható ebben a tekintetben. Az elektromágneses spektrum általánosan használt tartománya a 9-7. ábrán látható, az energia vagy hullámhossz kifejezésére használt különböző egységek összehasonlításával együtt.
A szerves vegyületek szerkezeti elemzéséhez használt spektroszkópia főbb fajtáit a 9-1. táblázat tartalmazza. Az elnyelt sugárzás frekvenciatartománya, valamint a sugárzás által keltett hatás és a szerkezetelemzésben hasznosított információ konkrét fajtája szerepel. A spektroszkópia alapelveinek rövid ismertetése után a gyakorlati laboratóriumi munka szempontjából leghasznosabb módszereket ismertetjük. Mindazonáltal nagyon fontos, hogy tisztában legyünk a speciális problémák megoldására alkalmazható egyéb, kevésbé rutinszerű módszerekkel, amelyek közül néhányat ebben a fejezetben, valamint a 19. és a 27. fejezetben tárgyalunk.
Gondot okozhatnak a spektroszkópiában általánosan használt különféle hullámhossz- és frekvenciaegységek közötti összefüggések. A hullámhossz, a frekvencia és a sebesség közötti kapcsolatnak világossá kell válnia számodra, ha elképzeled, hogy egy mólón állva nézed az óceán hullámait. Feltételezve, hogy a hullámok egyenletes távolságra vannak egymástól, a hullámhegyek között egyenletes távolság van, ami \(\lambda\), azaz a hullámhossz. A hullámhegyek percenként egy bizonyos számban haladnak el, ami \(\nu\), a frekvencia. A sebességet, \(c\), amellyel a hullámhegyek elhaladnak mellettünk, \(\lambda\) és \(\nu\) között az \(c = \lambda \nu\) összefüggés határozza meg.
Ez nem túl bonyolult, és ugyanolyan jól alkalmazható a vízhullámokra vagy az elektromágneses sugárzásra. Ami szinte szükségtelenül bonyolult, az az elektromágneses sugárzás \(\lambda\) és \(\nu\) kifejezésére általánosan használt különböző mértékegységek. Az egyik probléma a hagyomány, a másik a nagyon nagy vagy nagyon kicsi számok elkerülésének vágya. Így, ahogy a 9-7. ábra mutatja, olyan elektromágneses hullámhosszok érdekelhetnek bennünket, amelyek akár \(10^{16}\) szorzóval is eltérhetnek egymástól. Mivel az elektromágneses sugárzás sebessége a vákuumban állandó \(3 \szor 10^8 \: \text{m sec}^{-1}\), a frekvenciák ugyanezzel a tényezővel fognak különbözni.
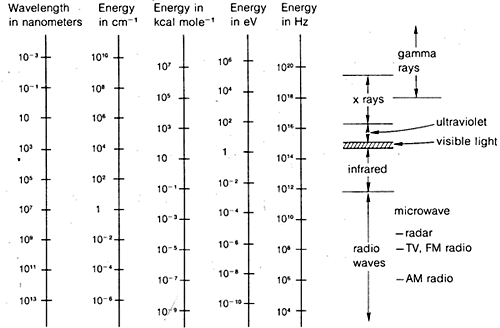
A hullámhosszra általánosan használt mértékegységek a méter (\(\(\text{m}\)), a centiméter (\(\(\text{cm}\)), a nanométer (\(\(\text{nm}\)) és a mikron (\(\mu\)). A múltban az angströmöket (\(Å\)) és a millimikronokat (\(\text{m} \mu m\)) is elég széles körben használták.
\
\
\
\
\
A frekvencia mértékegységei a másodpercenkénti ciklusok (cps) vagy a hertz (\(\text{Hz}\)), amelyek egyenértékűek (a fizikusok által széles körben használt másodpercenkénti sugár).
9-1. táblázat: A molekulaszerkezet elemzésére jelenleg használt főbb spektroszkópiai technikák

\
\
\
\
\(^3\)Egy hasznos leírást arról, hogyan lehet a molekulák szerkezetét “röntgensugaras látással” meghatározni, a Organic Molecules in Action XI. fejezetében találunk M. Goodman és F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert és Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, második kiadás. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. A tartalom szerzői jogvédelem alatt áll a következő feltételekkel: “Engedélyt adunk a mű egyéni, oktatási, kutatási és nem kereskedelmi célú sokszorosítására, terjesztésére, megjelenítésére és előadására bármilyen formátumban.”
.