Interprétation – Société des photographes ophtalmiques
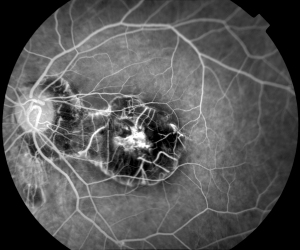
Interprétation descriptive
Timothy J. Bennett, CRA, OCT-C, FOPS
Penn State Hershey Eye Center
Hershey, Pennsylvanie
L’angiographie à la fluorescéine enregistre l’interaction dynamique de la fluorescéine avec les structures anatomiques normales et anormales du fond de l’œil. Une compréhension approfondie des phases de circulation et de l’apparence du colorant dans un œil normal est essentielle pour l’interprétation des anomalies. L’angiogramme normal
Dans un œil normal, les vaisseaux sanguins rétiniens et l’épithélium pigmentaire rétinien agissent tous deux comme des barrières à la fuite de fluorescéine dans la rétine. Les jonctions serrées des cellules endothéliales des capillaires rétiniens normaux les rendent imperméables aux fuites de fluorescéine. Les jonctions cellulaires serrées de l’épithélium pigmentaire rétinien sain constituent une barrière hémato-rétinienne externe empêchant la fuite choroïdienne normale de pénétrer dans les tissus rétiniens.
Des caractéristiques anatomiques supplémentaires contribuent à l’interprétation de l’angiographie à la fluorescéine. Le choriocapillaris est la couche riche en capillaires de la choroïde caractérisée par des parois capillaires fenêtrées qui laissent fuir le colorant fluorescéine librement dans l’espace extravasculaire à l’intérieur de la choroïde. Dans le fond postérieur, le choriocapillaris est disposé en une mosaïque de lobules qui explique la fluorescence choroïdienne inégale souvent observée dans les premières phases de l’angiographie. Les cellules épithéliales du pigment rétinien plus hautes et plus pigmentées ainsi que la présence de pigment xanthophylle et l’absence de capillaires rétiniens au centre de la fovéa (zone avasculaire fovéale) contribuent à l’hypofluorescence relative du centre de la macula.
Phases d’un angiogramme
Phase précoce
La phase précoce de l’angiogramme peut être divisée en phases de circulation distinctes qui sont utiles pour interpréter les résultats :
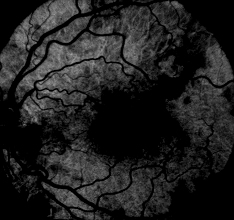
1. Flush choroïdien. Chez un patient normal, le colorant apparaît d’abord dans la choroïde environ 10 secondes après l’injection. Les principaux vaisseaux choroïdiens sont imperméables à la fluorescéine, mais le choriocapillaris laisse fuir le colorant fluorescéine librement dans l’espace extravasculaire. Il y a généralement peu de détails dans la chasse choroïdienne car l’épithélium pigmentaire rétinien (EPR) agit comme un filtre irrégulier qui obscurcit partiellement la vue de la choroïde. Si une artère ciliorétinienne est présente, elle se remplit en même temps que le flush choroïdien car tous deux sont alimentés par les courtes artères ciliaires postérieures.
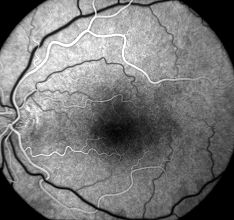
2. Phase artérielle. Les artérioles rétiniennes se remplissent typiquement une à deux secondes après la choroïde ; par conséquent, le temps de circulation normal « bras-rétine » est d’environ 12 secondes. Un retard dans le temps bras-rétine peut refléter un problème avec l’injection de colorant fluorescéine ou des problèmes circulatoires du patient, y compris des maladies cardiaques et vasculaires périphériques.
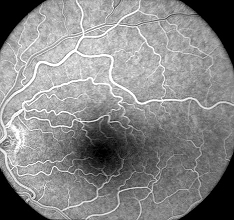
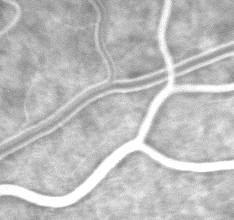
3. Phase artérioveineuse. Le remplissage complet du lit capillaire rétinien suit la phase artérielle et les veines rétiniennes commencent à se remplir. Au début de la phase artério-veineuse, de fines colonnes de fluorescéine sont visualisées le long des parois des plus grosses veines (flux laminaire). Ces colonnes s’élargissent à mesure que la totalité de la lumière se remplit de colorant.
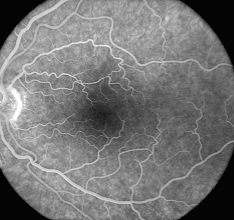
4. Phase veineuse. Le remplissage complet des veines se produit au cours des dix secondes suivantes, la fluorescence maximale des vaisseaux se produisant environ 30 secondes après l’injection. Le réseau capillaire périfovéal est mieux visualisé dans la phase veineuse maximale de l’angiogramme.
Phase moyenne
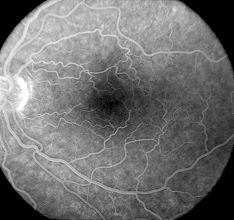
Aussi appelée phase de recirculation, elle se produit environ 2 à 4 minutes après l’injection. Les veines et les artères restent d’une luminosité à peu près égale. L’intensité de la fluorescence diminue lentement pendant cette phase, car une grande partie de la fluorescéine est éliminée de la circulation sanguine lors du premier passage dans les reins.
Phase tardive
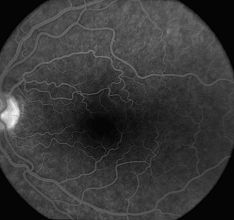
La phase tardive démontre l’élimination progressive du colorant de la vasculature rétinienne et choroïdienne. Les photographies sont généralement capturées 7 à 15 minutes après l’injection. La coloration tardive de la papille optique est un résultat normal. Toute autre zone d’hyperfluorescence tardive suggère la présence d’une anomalie.
L’angiographie anormale
Les résultats angiographiques anormaux
Hypofluorescence
- Défaut de remplissage
- Défaut de blocage
Hyperfluorescence
- .
- Autofluorescence
- Psuédofluorescence
- Défaut de transmission ou de « fenêtre »
- Fuite
- Mise en commun
- Tenue
Dans l’évaluation des maladies de la macula, l’angiographie à la fluorescéine est utile pour détecter les anomalies du flux sanguin, de la perméabilité vasculaire, des schémas vasculaires rétiniens et choroïdiens, de l’épithélium pigmentaire rétinien et de diverses autres modifications.1 L’interprétation de l’angiogramme anormal repose sur l’identification des zones qui présentent une hypofluorescence ou une hyperfluorescence. Il s’agit de termes descriptifs qui font référence à la luminosité relative de la fluorescence en fonction du temps par rapport à une étude normale.
Hypofluorescence
L’hypofluorescence est la réduction ou l’absence de la fluorescence normale. L’hypofluorescence est causée soit par un blocage du schéma de fluorescence normal, soit par des anomalies de la perfusion vasculaire choroïdienne ou rétinienne.
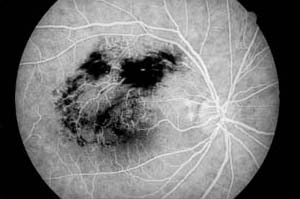
La fluorescence bloquée est le plus souvent causée par le sang mais peut résulter du dépôt de matériaux anormaux tels que l’exsudat lipidique, la lipofuscine, le pigment xanthophylle ou le pigment de mélanine. L’angiographie à la fluorescéine est très utile pour déterminer l’emplacement anatomique du matériau bloquant, ce qui est important pour identifier l’étiologie de l’anomalie. Par exemple, une hémorragie prérétinienne due à une rétinopathie diabétique proliférante bloque la visibilité des vaisseaux rétiniens et choroïdiens, tandis que le sang sous-rétinien provenant d’une dégénérescence maculaire exsudative liée à l’âge ne masque que la circulation choroïdienne.
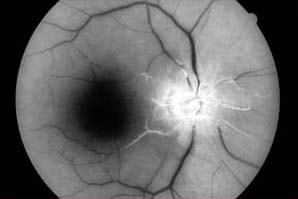
Une perfusion vasculaire anormale entraîne une hypofluorescence de la circulation rétinienne et/ou choroïdienne selon la localisation de l’anomalie. Les causes courantes d’hypoperfusion rétinienne comprennent les occlusions artérielles et veineuses rétiniennes et les maladies ischémiques dues au diabète et à d’autres causes. L’hypoperfusion choroïdienne peut être produite par une occlusion de l’artère ophtalmique, une artérite à cellules géantes et une choroïdopathie hypertensive. Il est important de comprendre la relation entre l’hypofluorescence due aux défauts de remplissage et la phase spécifique de l’angiogramme. Par exemple, dans de nombreuses occlusions vasculaires, l’hypofluorescence peut être une découverte temporaire jusqu’à ce qu’un remplissage retardé du vaisseau affecté se produise dans les phases ultérieures de l’étude.
Hyperfluorescence
L’hyperfluorescence est une augmentation de la fluorescence résultant de la transmission accrue de la fluorescence normale ou d’une présence anormale de fluorescéine à un moment donné de l’angiogramme.
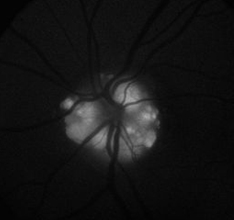
L’autofluorescence et la pseudofluorescence sont des termes pour décrire l’apparition d’une hyperfluorescence apparente en l’absence de fluorescéine. L’autofluorescence fait référence à l’hyperfluorescence enregistrable qui est censée se produire naturellement dans certaines entités pathologiques telles que les drusens du nerf optique et les hamartomes astrocytaires. Certains drusens discaux, mais pas tous, semblent fluorescents sous lumière bleue. Une certaine controverse a existé pour savoir s’il s’agit d’une véritable fluorescence ou s’il peut également y avoir une composante réfléchissante.2 Ces structures sont très réfléchissantes dans la même gamme spectrale de fluorescence et pourraient en fait présenter une pseudofluorescence.
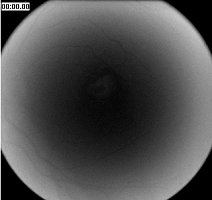
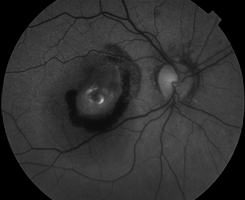
La pseudofluorescence se produit en raison du croisement des courbes de transmission spectrale des filtres excitateurs et des filtres barrières. Si le croisement est trop important, la réflectance des structures claires du fond d’œil ne sera pas entièrement bloquée par le filtre barrière. Le crossover peut être le résultat de filtres mal adaptés ou vieillissants. Les filtres interférentiels modernes présentent rarement un croisement significatif, à moins qu’ils ne soient détériorés. Des photographies de contrôle sont systématiquement prises avant l’injection de fluorescéine pour détecter la présence éventuelle de pseudofluorescence. La photographie de gauche montre une légère pseudofluorescence avant l’injection (minuterie à zéro). L’exemple de droite démontre un exemple extrême avec un gain numérique augmenté pour amplifier l’exposition.
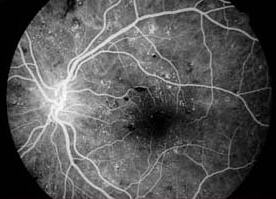
Défaut de transmission. Selon la densité de la pigmentation rétinienne, la fluorescence de fond de la choroïde peut être visible comme hyperfluorescence dans l’angiogramme. Un » défaut de fenêtre » est une zone d’hyperfluorescence qui se produit lorsqu’il y a une absence ou une réduction de la pigmentation due à une lésion de l’épithélium pigmentaire rétinien. La perte de pigment permet de visualiser la fluorescence créée par le choriocapillaris sous-jacent. Les défauts de la fenêtre restent de taille uniforme tout au long de l’angiogramme. Leur luminosité augmente et diminue avec la fluorescence choroïdienne. Il est important de différencier l’hyperfluorescence due aux défauts de transmission de la fuite.
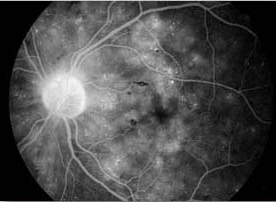
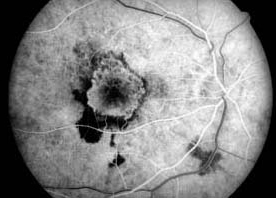
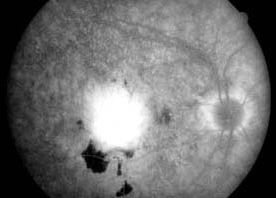
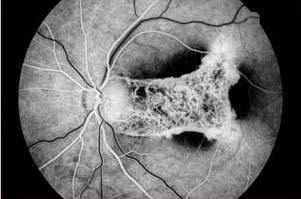
La fuite fait référence à l’hyperfluorescence dans l’angiogramme due à l’extravasation du colorant fluorescéine. La fuite peut résulter de la perturbation des jonctions serrées des cellules endothéliales vasculaires rétiniennes ou de la rupture des jonctions serrées entre les cellules épithéliales pigmentaires rétiniennes (respectivement les barrières sang-rétine interne et externe). Les exemples incluent l’œdème maculaire de la rétinopathie diabétique, l’œdème maculaire cystoïde et la choriorétinopathie séreuse centrale. Outre les anomalies du système vasculaire rétinien ou de l’épithélium pigmentaire, des fuites sont observées dans diverses conditions associées au développement de nouveaux vaisseaux sanguins. Par exemple, une fuite de fluorescéine est observée dans les yeux présentant une néovascularisation choroïdienne liée à une dégénérescence maculaire liée à l’âge. Chez ces patients, l’angiographie à la fluorescéine est nécessaire pour identifier l’emplacement et les caractéristiques de la membrane néovasculaire choroïdienne qui, à son tour, influence le cours du traitement. Dans les yeux atteints de rétinopathie diabétique proliférante, la néovascularisation de la papille optique ou de la rétine est caractérisée par une fuite intense de fluorescéine. La fuite peut entraîner une coloration tardive ou une mise en commun du colorant.
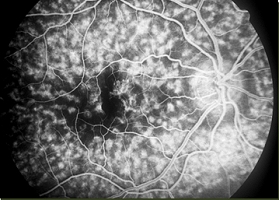
La mise en commun fait référence à une hyperfluorescence tardive résultant de l’accumulation du colorant fluorescéine dans certains tissus. Les drusens et les cicatrices choriorétiniennes présentent fréquemment une coloration. Une coloration normale peut se produire dans le nerf optique et la sclère en raison d’une fuite choroïdienne normale. La coloration sclérale n’est généralement visible que lorsqu’il y a une réduction ou une absence de l’épithélium pigmentaire (défaut de fenêtre) et que la sclère peut être vue cliniquement.
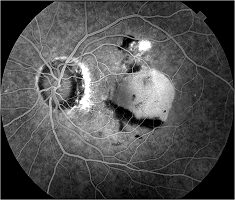
La mise en commun est l’accumulation de colorant dans un espace anatomique distinct. Le pooling peut se produire dans les décollements séreux de la rétine sensorielle ou de l’épithélium pigmentaire rétinien en raison d’une rupture de la barrière hémato-rétinienne. La choriorétinopathie séreuse centrale est une condition qui démontre souvent l’accumulation de fluorescéine.