Withaferin A: un potencial agente terapéutico contra la infección por COVID-19
La nueva enfermedad por coronavirus 2019 (COVID-19) se ha extendido rápidamente por todo el mundo desde que se informó por primera vez en diciembre de 2019 dentro de Wuhan, China, como una neumonía de etiología desconocida . El síndrome respiratorio agudo severo coronavirus-2 (SARS-CoV-2), denominado por la Organización Mundial de la Salud (OMS), representa la tercera epidemia a gran escala relacionada con los coronavirus . Aunque la enfermedad se notificó por primera vez en China, un estudio retrospectivo ha encontrado posteriormente pruebas de que el SRAS-CoV-2 se estaba propagando en Francia 4 días antes de que se notificara por primera vez en Wuhan (China) y 1 mes antes del primer caso oficial en el país . Desde su descubrimiento inicial, el SARS-CoV-2 se ha extendido por todo el mundo, infectando a más de 11,5 millones de personas y provocando la muerte de más de 530.000 personas hasta el 6 de julio de 2020 . La gravedad de la enfermedad oscila ampliamente entre un estado asintomático de la enfermedad y pacientes que presentan un síndrome de dificultad respiratoria aguda (SDRA), que requiere una intervención médica crítica para intentar evitar la muerte del paciente . Posteriormente se descubrió que la enzima convertidora de angiotensina 2 (ECA2) es un receptor funcional para la proteína de espiga (S-) del SARS-CoV-2, lo que permite que el virus entre en las células . La ACE2 es un potente regulador negativo del sistema renina-angiotensina (SRA), que es crítico para mantener la homeostasis del SRA.
El gen de la ACE2 está compuesto por 805 aminoácidos y es una glicoproteína integral de membrana de tipo I. La ECA2 degrada la angiotensina (Ang)-II, un potente vasoconstrictor (que también es proinflamatorio y promueve la fibrosis), y la convierte en Ang (1-7) . La Ang (1-7) es un vasodilatador que también inhibe la proliferación y la apoptosis. Además del efecto sistémico en la regulación de la presión arterial, la ECA2 tiene efectos reguladores locales en los cambios patológicos de varios órganos, incluidos el corazón, el riñón y los pulmones. La ACE2 se expresa en gran medida en las células alveolares del pulmón, proporcionando el principal sitio de entrada del virus en el huésped humano. Además de la expresión de la ACE2 en las células alveolares del pulmón, también se expresa en varios tejidos, entre ellos el sistema vascular (células endoteliales, células angiogénicas migratorias y células musculares lisas vasculares), el corazón (cardiofibroblastos, cardiomiocitos, células endoteliales, pericitos y células adiposas epicárdicas) y los riñones (células endoteliales glomerulares, podocitos y células epiteliales del túbulo proximal) el hígado (colangiocitos y hepatocitos), la retina (células epiteliales pigmentadas, células fotorreceptoras de bastones y conos, y células gliales de Müller), los enterocitos de los intestinos, los órganos circunventriculares del sistema nervioso central y las vías respiratorias superiores (células epiteliales caliciformes y ciliadas) .
Hay dos subunidades de la proteína S del SARS-CoV-2: la subunidad S1 tiene un dominio de unión al receptor que se acopla con el receptor de la célula huésped ACE2, y la subunidad S2 está implicada en la regulación de la fusión entre la membrana viral y la del huésped . Se ha informado de que el SARS-CoV-2 tiene una afinidad diez veces mayor por el ACE2 en comparación con el SARS-CoV, lo que concuerda con la mayor eficacia de la infección del SARS-CoV-2 . Aunque actualmente no se ha encontrado ninguna cura, se están realizando varios ensayos clínicos para determinar cuál es el régimen de tratamiento más eficaz para el COVID-19, con una amplia lista de posibles terapias que se detallan en una revisión de Gosain et al. . En la actualidad, el tratamiento de los pacientes consiste en un tratamiento de apoyo y en medidas para evitar la propagación del virus. A pesar de las diferencias en las características de la población de pacientes entre Europa y China, dos de los principales determinantes del riesgo de mortalidad de los pacientes que se encontraron en ambos grupos son la edad y la presencia de condiciones comórbidas subyacentes . Una de estas afecciones subyacentes asociada a un aumento de la mortalidad de los pacientes con COVID-19 es la presencia de cáncer.
Los pacientes con cáncer y la epidemia de COVID-19
Debido a su estado potencialmente inmunodeprimido, el tratamiento adecuado de los pacientes con cáncer es un problema real y grave al que se enfrentan los oncólogos, independientemente de que el paciente sufra una infección por SARS-CoV-2 . Los datos de cuatro focos de SARS-CoV-2 (Estados Unidos, Italia, España y China) han demostrado que los pacientes con cáncer infectados por el nuevo coronavirus tienen un riesgo significativamente mayor de ingresar en una unidad de cuidados intensivos (UCI) y/o de necesitar ventilación mecánica, así como un aumento de la mortalidad de los pacientes . En un estudio retrospectivo, la tasa de mortalidad de los pacientes con cáncer en China infectados por el COVID-19 fue de aproximadamente el 28%, en comparación con la tasa de mortalidad sintomática general del 1,4% o la tasa de mortalidad bruta del 4,5% en China. Tal vez no resulte sorprendente que la tasa de mortalidad de los pacientes con cáncer de pulmón infectados por el SARS-CoV-2 sea bastante sombría, ya que un estudio de cohortes de Nueva York mostró una tasa de mortalidad del 55%. Los pacientes con cáncer y sus oncólogos se enfrentan actualmente al dilema de si el paciente debe o no iniciar o continuar la terapia para su estado de enfermedad primario debido a los riesgos asociados de contraer el SARS-CoV-2 y a la reducción de los recursos disponibles para el personal sanitario . La información sobre la etiología específica del cáncer es escasa en varios estudios sobre el SRAS-CoV-2. Sin embargo, se han notificado cánceres de pulmón, mama, gastrointestinales y hematológicos (por ejemplo, linfoma) dentro de los estudios de cohorte COVID-19 en Estados Unidos, Italia y China. Además, en estos estudios se ha informado de pacientes con cáncer de cuello de útero y con otras neoplasias ginecológicas no especificadas.
Si bien algunas fuentes bibliográficas seleccionadas permiten vislumbrar los paradigmas oncológicos expuestos, la población de pacientes evaluada, ya de por sí pequeña, se reduce aún más cuando se estratifica por tipología oncológica. Esta es una limitación sustancial para evaluar el riesgo de mortalidad y proporcionar directrices para el tratamiento de los pacientes con cáncer COVID-19 positivo. En una línea similar, se sabe muy poco sobre la infección por COVID-19 en pacientes con cáncer de ovario. En el momento de escribir este artículo, hay 22 artículos en PubMed sobre el tema, de los cuales 20 discuten los posibles cambios o retos a los que se enfrentan las clínicas oncológicas para atender mejor a las pacientes con cáncer de ovario. Los dos artículos restantes hablan de un total de tres pacientes con cáncer de ovario y de cómo se modificó su tratamiento debido a la actual pandemia . Sólo dos de las tres pacientes con cáncer de ovario resultaron positivas al nuevo coronavirus, lo que requirió un tratamiento adyuvante con plaquetas debido al desarrollo de trombocitopenia relacionada con la quimioterapia . La paciente con cáncer de ovario restante dio negativo en la prueba de infección por SARS-CoV-2, pero se presumió que era positiva basándose en los síntomas de la paciente y en los hallazgos clínicos (por ejemplo, hallazgos anormales en la tomografía computarizada consistentes con neumonía en pacientes con COVID-19) . El régimen oncológico de este paciente se retrasó hasta la resolución de la neumonía atípica que presentaba, pero por lo demás no recibió ninguna terapia adyuvante . En la actualidad, no existen directrices aceptadas a nivel mundial para abordar el tratamiento de los pacientes con cáncer en el contexto de una pandemia debido a la falta de datos disponibles. Recientemente, una colaboración internacional ha propuesto una serie de enfoques prácticos para el diagnóstico y el tratamiento de los pacientes con cáncer . Sin embargo, hasta que se disponga de más información o de un régimen terapéutico eficaz contra el SARS-CoV-2, los pacientes con cáncer seguirán teniendo un riesgo muy alto de mortalidad debido a la epidemia de COVID-19.
La witaferina a como tratamiento prospectivo
La witaferina A (WFA) es una lactona esteroidea aislada de la planta Withania somnifera, también conocida como Ashwagandha . Es conocida por sus propiedades antiinflamatorias, así como por sus propiedades antitumorales . Trabajos recientes han demostrado que las infecciones por COVID-19 tienen un gran componente inmunitario y pueden provocar el desarrollo de una tormenta de citoquinas, una reacción inmunitaria potencialmente mortal en la que el organismo libera demasiadas citoquinas en la sangre a un ritmo rápido. Los trabajos de nuestro laboratorio han demostrado que el WFA es capaz de reducir la secreción de varias citoquinas proinflamatorias (por ejemplo, TNFα, IL-6, IL-8 e IL-18) en un modelo metastásico de cáncer de ovario. Es posible que el tratamiento con el WFA pueda abrogar la intensidad de la tormenta de citoquinas debido a sus propiedades antiinflamatorias. Curiosamente, al menos tres grupos de investigación independientes han sugerido que los fitoquímicos encontrados en la planta Withania somnifera podrían desarrollarse como un agente terapéutico contra la infección por COVID-19 utilizando enfoques de acoplamiento molecular . Dos de los grupos informaron que varios Withanolides, como el WFA, deberían ser capaces de unirse al dominio de unión del receptor de la proteína S viral, bloqueando o reduciendo así las interacciones con el receptor ACE2 del huésped . El tercer grupo informó que el WFA y un withanólido separado, Withanone, se predice que interactúan con la proteasa principal del SARS-CoV-2, aunque se predice que el WFA tiene menos afinidad de unión que un inhibidor de la proteasa N3 establecido utilizado para las puntuaciones de acoplamiento de referencia.
En un estudio no relacionado, nuestro grupo ha estado investigando el WFA como un potencial terapéutico para tratar el cáncer, incluyendo la orientación de las células madre del cáncer y la caquexia inducida por el cáncer (un trastorno de desgaste muscular). Como la señalización de la Ang-II es un mediador conocido de la atrofia del músculo esquelético, investigamos el efecto del WFA en la señalización de la Ang-II en lo que respecta a la caquexia. Los datos (en proceso de publicación) de nuestro laboratorio han indicado que el tratamiento con WFA puede reducir los niveles circulantes de Angiotensina II en un modelo experimental de caquexia inducida por cáncer. En este estudio, xenografiamos la línea celular de cáncer de ovario A2780 (8,0 × 105 células de bajo paso resuspendidas en 100 μl de PBS estéril) por vía intraperitoneal en ratones hembra NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG; Jackson Lab Strain # 005557) de 5 a 6 semanas de edad. Los controles libres de tumores recibieron una inyección i.p. equivalente de solución salina estéril. Después de un periodo refractario de 8 días para permitir el injerto de las células de cáncer de ovario, los animales libres de tumor y portadores de tumor recibieron inyecciones i.p. de WFA (2 mg/kg) o vehículo (dimetilsulfóxido al 10%, trioctanoato de glicerol al 90%) una vez cada 3 días durante el periodo de 4 semanas (post-xenoinjerto).
Usando qPCR y cebadores específicos de genes, descubrimos que el tratamiento con WFA redujo la expresión relativa de ARNm de AT1R (Receptor de Angiotensina II Tipo 1) en comparación con el grupo tratado con vehículo en las muestras tumorales, tal como se determinó mediante un análisis de varianza de dos vías (ANOVA) seguido del análisis post hoc de la prueba de comparación múltiple de Tukey. Basándonos en nuestros descubrimientos y en los estudios de acoplamiento molecular reportados de forma independiente, investigamos si el tratamiento con WFA alteraría o no la expresión de ACE2 en los pulmones en condiciones libres de tumor y con tumor. Curiosamente, no encontramos diferencias significativas (NSD; p-valores > 0,80 para todas las comparaciones) en la expresión relativa de ARNm de ACE2 en respuesta al tratamiento con WFA como se determinó por un ANOVA de dos vías (Fig. 1). Como no observamos ninguna diferencia significativa en la expresión de mRNA de ACE2 en los pulmones mediante qPCR, una de las principales regiones donde se expresa ACE2, no investigamos la expresión de ACE2 en otros órganos. Sin embargo, recientemente se ha informado de que, como subproducto de la infección por SARS-CoV-2, la expresión de ACE2 disminuye como parte del proceso de la enfermedad, lo que a su vez facilita el desarrollo del daño multiorgánico . Debido a este efecto, otros han sugerido que bloquear la unión del SARS-CoV-2 al receptor de la ECA2 puede ser una estrategia más beneficiosa para combatir el virus que aumentar la expresión de la ECA2, debido a su efecto antagónico sobre la señalización del AT1R . En línea con este razonamiento, está dentro del ámbito de la posibilidad de que el WFA pueda bloquear o impedir el COVID-19 a través de interacciones con la proteína S viral sobre la base de los estudios de acoplamiento molecular , sin afectar a la expresión de ACE2 (como se informó en nuestros datos) que conduce a un empeoramiento del estado patológico.
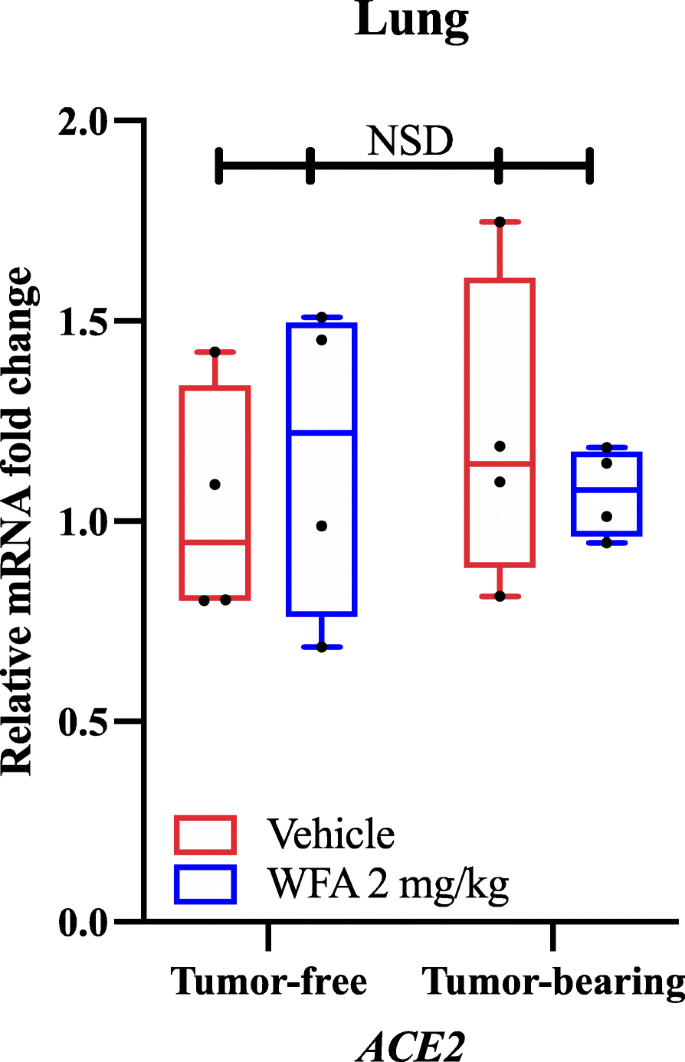
Efecto de la witaferina A sobre la expresión del ARNm de ACE2. (A) Niveles relativos de ARNm de la ECA2 en muestras de pulmón de ratones hembra NSG libres de tumor y portadores del tumor de ovario A2780 tratados con vehículo o con WFA (2 mg/kg). N = 4-5 ratones por grupo. Los círculos negros indican puntos de datos individuales. NSD = Sin diferencias significativas