News
Juli 20, 2015
Ergebnisse liefern potenzielles neues Ziel, um in den Lebenszyklus von Viren einzugreifen
Von Jocelyn Duffy / 412-268-9982 / [email protected]
Alle Viren haben eine robuste Hülle, die das genetische Material im Inneren umgibt und schützt, so dass die Viruspartikel stabil und infektiös bleiben und sich verbreiten können. Der Biophysiker Alex Evilevitch und seine Kollegen von der Carnegie Mellon University haben nun die Achillesferse dieser harten Schale identifiziert.
Die im Journal of Virology, der führenden Fachzeitschrift auf diesem Gebiet, veröffentlichten Ergebnisse zeigen den schwächsten Teil der viralen Schale auf und bieten ein potenzielles neues Ziel, um in den viralen Lebenszyklus einzugreifen und stabile Gentherapie-Träger zu entwickeln.
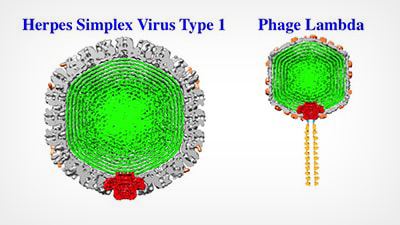
Viren wie Herpes Simplex 1 und Phage Lambda haben eine harte äußere Schale (grau), die die virale DNA (grün) umschließt und schützt. Alex Evilevitch und seine Kollegen haben nun die Achillesferse dieser harten Schale identifiziert: das virale Portal (rot). Bei den obigen Bildern handelt es sich um Cryo-EM-Rekonstruktionen; das Portal-Schema ist eingeblendet.
Die äußere Hülle, das so genannte Kapsid, umschließt das genetische Material eines Virus. Viren wie das Herpes Simplex Virus Typ 1 (HSV-1) enthalten doppelsträngige DNA, deren lange Stränge dicht gepackt sind und einen enormen Druck von bis zu zehn Atmosphären auf die innere Kapsidwand ausüben. In früheren Arbeiten hat Evilevitch diesen Druck zum ersten Mal in HSV-1 gemessen; er hat auch gezeigt, dass es dieser Druck ist, der die DNA aus einer kleinen Pforte im Viruskapsid in eine Wirtszelle treibt.
Mit seinen neuesten Forschungen zeigen Evilevitch und der Physik-Diplomstudent David Bauer, dass die Pforte mehr als nur ein Kanal für die DNA ist. Es ist auch der schwächste strukturelle Teil des Kapsids.
„Das Aufregendste hier ist, dass wir zum ersten Mal gezeigt haben, wie der Druck der DNA die Stabilität des Portals beeinflusst, was letztendlich die Stabilität des Virus über die Zeit und bei jeder Temperatur bestimmt“, sagte Evilevitch, außerordentlicher Professor für Physik und Mitglied des CMU-Zentrums für Mechanik und Technik zellulärer Systeme.
Das Portal ist eine kritische Komponente von Viruskapsiden. Der aus mehreren verschiedenen Proteinen bestehende Portalkomplex verpackt aktiv die DNA während des viralen Aufbaus, setzt die DNA während der Infektion frei und ist, wie die neue Forschung zeigt, der Schlüssel zur Aufrechterhaltung des empfindlichen Gleichgewichts des Kapsids, das stabil genug ist, um das Genom zu bewahren, und gleichzeitig instabil genug, um eine effiziente Freisetzung des Genoms während der Infektion zu ermöglichen.
„Frühere Experimente haben die Rolle des internen Drucks auf die strukturelle Integrität von Viruskapsiden untersucht“, sagte Evilevitch. „Hier liefern wir den ersten experimentellen Beweis dafür, dass es die mechanische Festigkeit des Portalkomplexes selbst ist, die die Stabilität des Virus in Bezug auf die Retention des Genoms bestimmt.“
„Das Aufregendste hier ist, dass wir zum ersten Mal gezeigt haben, wie der DNA-Druck die Portalstabilität beeinflusst, die letztendlich die Stabilität des Virus über die Zeit und bei jeder Temperatur bestimmt.“ – Alex Evilevitch
Für diese Studie untersuchten Evilevitch und sein Team die Stabilität des Portalkomplexes in drei verschiedenen Viren – zwei Viren, die Bakterien infizieren (Lambda und P22) und eines, das menschliche Zellen infiziert (HSV-1). Alle drei Viren enthalten doppelsträngige DNA, die Druck auf die Kapsidwand ausübt.
Mit einem neuartigen, von ihnen entwickelten Differentialscanning-Mikrokalorimetrie-Assay erhitzten die Forscher die Virusproben und ermittelten die Temperatur, bei der sich das Portal öffnet, um DNA freizugeben. Diese Temperatur spiegelt die mechanische Stabilität des Portals wider.
Für jeden untersuchten Virustyp erzeugten die Forscher mutierte Stämme des Virus, indem sie die Länge der verpackten DNA im Inneren variierten und so Mutanten mit unterschiedlichem Innendruck erzeugten. Die Ergebnisse der Tests zeigten, dass Mutanten mit mehr verpackter DNA und daher mehr Druck ihre DNA bei einer niedrigeren Temperatur durch das Portal freisetzen. Dieser Befund deutet darauf hin, dass die mechanische Kraft des Genoms, die gegen das Portal des Virus drückt, dieses destabilisiert und es anfällig für ein Aufbrechen macht.
Zusätzlich verglich das Forscherteam die Temperatur der DNA-Freisetzung für die drei verschiedenen Virustypen. Die Ergebnisse zeigten, dass die Stabilität des Portals bei Viren mit längeren Genomen und daher höherem Druck im Inneren zunimmt.
„Unsere Ergebnisse deuten darauf hin, dass sich der Portalkomplex so entwickelt hat, dass er der nach außen gerichteten Kraft des verpackten Genoms standhält und gleichzeitig eine effiziente DNA-Freisetzung während der Infektion gewährleistet“, so Evilevitch. „Ein besseres Verständnis dieses Gleichgewichts zwischen internem Druck und Portalstabilität bietet neue Einblicke, um die virale Replikation zu stören und virale Vektoren für die Gentherapie zu entwerfen, die fremde Nukleinsäure stabil zurückhalten können.“
Neben Evilevitch und Bauer sind folgende Forscher an dem Projekt beteiligt: Dong Li von der CMU; Fred Homa und Jamie Huffman von der University of Pittsburgh School of Medicine; Kasandra Wilson, Justin Leavitt und Sherwood Casjens von der University of Utah School of Medicine; und Joel Baines von der Louisiana State University School of Veterinary Medicine.
Diese Forschung wurde vom Schwedischen Forschungsrat und der National Science Foundation (CHE-1152770 an AE) finanziert, mit zusätzlicher Unterstützung durch Zuschüsse des öffentlichen Gesundheitsdienstes und ein Ausbildungsstipendium der National Institutes of Health.