9.4: Warum kann man Moleküle nicht sehen?
Am einfachsten ließe sich die Struktur von Molekülen bestimmen, indem man „sieht“, wie die Kerne angeordnet sind und wie die Elektronen verteilt sind. Das ist mit sichtbarem Licht nicht möglich, weil die Wellenlängen des sichtbaren Lichts sehr viel länger sind als die üblichen Molekülabmessungen. Ein Elektronenstrahl kann die erforderlichen kurzen Wellenlängen haben, aber kleine organische Moleküle werden durch die Bestrahlung mit Elektronen der richtigen Wellenlängen schnell zerstört. Dennoch ist die Elektronenmikroskopie eine wertvolle Technik für die Untersuchung großer Moleküle wie der DNA, die vor der Betrachtung mit Schwermetallatomen angefärbt werden können oder selbst relativ stabil gegenüber einem Elektronenstrahl sind (Abbildungen 9-4 und 9-5).

Fast alle Teile des Spektrums elektromagnetischer Strahlung, von Röntgenstrahlen bis hin zu Radiowellen, haben eine praktische Anwendung für die Untersuchung organischer Moleküle. Besonders wertvoll ist der Einsatz der Röntgenbeugung zur Bestimmung der Strukturen von Molekülen in Kristallen, und in den letzten zehn Jahren ist diese Technik fast zur Routine geworden. Abbildung 9-6 zeigt die detaillierte Anordnung der Kohlenstoffe, Wasserstoffe und Bromverbindungen in 1,8-Bis(brommethyl)naphthalin, \(1\), wie sie durch Röntgenbeugung bestimmt wurde. Die verwendeten Geräte und Techniken sind sehr komplex und stehen noch nicht vielen organischen Laboratorien zur Verfügung.\(^3\)
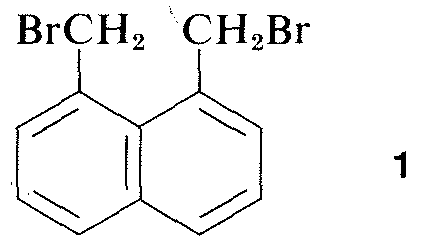
Andere Beugungsmethoden sind die Elektronenbeugung, die zur Bestimmung der Strukturen von Gasen oder flüchtigen flüssigen Substanzen verwendet werden kann, die nicht als für die Röntgenbeugung geeignete Kristalle erhalten werden können, und die Neutronenbeugung, die besonders für Kristalle geeignet ist, in denen die genaue Lage der Wasserstoffe gesucht wird. Wasserstoff hat kein ausreichendes Streuvermögen für die genaue Lokalisierung von Röntgenstrahlen durch Röntgenbeugung.
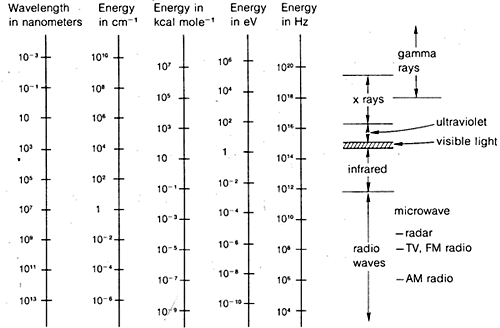
Die Beugungsmethoden können zur Bestimmung vollständiger Strukturen organischer Moleküle verwendet werden, sind aber nicht routinemäßig genug, um allgemein in der praktischen organischen Laborarbeit eingesetzt zu werden. Aus diesem Grund werden wir im weiteren Verlauf dieses Kapitels diejenigen Formen der Spektroskopie hervorheben, die allgemein für den routinemäßigen Laborgebrauch zur Verfügung stehen. Wie wir sehen werden, werden diese Methoden von organischen Chemikern auf mehr oder weniger empirische Weise verwendet. Im Allgemeinen beruhen spektroskopische Methoden auf irgendeiner Form der Anregung von Molekülen durch Absorption elektromagnetischer Strahlung, und wie wir bereits gesagt haben, sind praktisch alle Teile des elektromagnetischen Spektrums in dieser Hinsicht nützlich. Der üblicherweise verwendete Bereich des elektromagnetischen Spektrums ist in Abbildung 9-7 dargestellt, zusammen mit einem Vergleich der verschiedenen Einheiten, die verwendet werden, um Energie oder Wellenlänge auszudrücken.
Die wichtigsten Arten der Spektroskopie, die für die Strukturanalyse organischer Verbindungen verwendet werden, sind in Tabelle 9-1 aufgeführt. Der Frequenzbereich der absorbierten Strahlung ist angegeben, ebenso wie die von der Strahlung erzeugte Wirkung und die spezifische Art der Information, die bei der Strukturanalyse verwendet wird. Nach einer kurzen Darstellung der Prinzipien der Spektroskopie werden die Methoden beschrieben, die für die praktische Arbeit im Labor von größtem Nutzen sind. Dennoch ist es sehr wichtig, die anderen, weniger routinemäßigen Methoden zu kennen, die zur Lösung spezieller Probleme eingesetzt werden können, und einige davon werden in diesem Kapitel und in den Kapiteln 19 und 27 behandelt.
Sie haben vielleicht Probleme mit den Beziehungen zwischen den verschiedenen Wellenlängen- und Frequenzeinheiten, die in der Spektroskopie üblicherweise verwendet werden. Die Beziehung zwischen Wellenlänge, Frequenz und Geschwindigkeit sollte Ihnen klar werden, wenn Sie sich vorstellen, dass Sie auf einem Pier stehen und die vorbeiziehenden Meereswellen beobachten. Unter der Annahme, dass die Wellen gleichmäßig verteilt sind, ergibt sich ein gleichmäßiger Abstand zwischen den Wellenkämmen, der \(\lambda\), der Wellenlänge, entspricht. Die Wellenberge werden in einer bestimmten Anzahl pro Minute vorbeiziehen, was \(\nu\), der Frequenz, entspricht. Die Geschwindigkeit, \(c\), mit der die Wellenkämme an dir vorbeiziehen, hängt mit \(\lambda\) und \(\nu\) durch die Beziehung \(c = \lambda \nu\) zusammen.
Dies ist nicht wirklich sehr kompliziert und gilt gleichermaßen für Wasserwellen oder elektromagnetische Strahlung. Was fast unnötig kompliziert ist, ist die Vielfalt der Einheiten, die üblicherweise verwendet werden, um \(\lambda\) und \(\nu\) für elektromagnetische Strahlung auszudrücken. Das eine Problem ist die Tradition, das andere ist der Wunsch, sehr große oder sehr kleine Zahlen zu vermeiden. Wie Abbildung 9-7 zeigt, können wir uns also für elektromagnetische Wellenlängen interessieren, die sich um einen Faktor \(10^{16}\) unterscheiden. Da die Geschwindigkeit der elektromagnetischen Strahlung im Vakuum konstant bei \(3 \mal 10^8 \: \text{m sec}^{-1}\) liegt, unterscheiden sich die Frequenzen um denselben Faktor.
Gebräuchliche Einheiten für die Wellenlänge sind Meter (\(\text{m}\)), Zentimeter (\(\text{cm}\)), Nanometer (\(\text{nm}\)) und Mikrometer (\(\mu\)). In der Vergangenheit wurden auch Angström (\(Å\)) und Millimikron (\(\text{m} \mu m\)) recht häufig verwendet.
\
\
\
\
Frequenzeinheiten werden in Zyklen pro Sekunde (cps) oder Hertz (\(\text{Hz}\)) angegeben, die gleichwertig sind (Radiant pro Sekunde wird von Physikern häufig verwendet).
Tabelle 9-1: Die wichtigsten spektroskopischen Techniken, die derzeit für die Analyse der Molekularstruktur verwendet werden

\
\
\
\(^3\)Eine nützliche Beschreibung, wie Molekülstrukturen durch „Röntgenblick“ bestimmt werden können, findet sich in Kapitel XI von Organic Molecules in Action von M. Goodman und F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert und Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Dieser Inhalt ist unter folgenden Bedingungen urheberrechtlich geschützt: „Sie erhalten die Erlaubnis zur individuellen, bildungsbezogenen, forschungsbezogenen und nicht kommerziellen Vervielfältigung, Verbreitung, Darstellung und Aufführung dieses Werks in jedem Format.“