News
20. července, 2015
Nálezy představují potenciální nový cíl pro zásah do životního cyklu virů
Autor: Jocelyn Duffy / 412-268-9982 / [email protected]
Všechny viry mají průmyslově odolný obal, který obklopuje a chrání genetický materiál uvnitř, což umožňuje virovým částicím zůstat stabilní, infekční a schopné šíření. Biofyzik Alex Evilevitch z Carnegie Mellon University a jeho kolegové nyní identifikovali Achillovu patu tohoto pevného obalu.
Zjištění publikovaná v Journal of Virology, špičkovém časopise v oboru, přesně určují nejslabší část virového obalu a poskytují potenciální nový cíl pro zásah do životního cyklu viru a pro vývoj stabilních nosičů genové terapie.
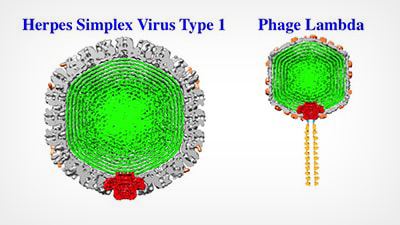
Viry jako Herpes Simplex 1 a Phage Lambda mají pevný vnější obal (šedý), který obaluje a chrání virovou DNA (zelený). Alex Evilevitch a jeho kolegové nyní identifikovali Achillovu patu tohoto tvrdého obalu, virový portál (červeně). Výše uvedené obrázky jsou rekonstrukce Cryo EM; schéma portálu je superponováno.
Vnější obal, nazývaný kapsida, uzavírá genetický materiál viru. Viry, jako je virus Herpes Simplex typu 1 (HSV-1), obsahují dvouvláknovou DNA, jejíž dlouhá vlákna jsou pevně zabalena a vyvíjejí na vnitřní stěnu kapsidy obrovský tlak, který dosahuje desítek atmosfér. V předchozí práci Evilevitch poprvé změřil tento tlak v HSV-1; ukázal také, že je to právě tento tlak, který pohání DNA z malého portálu v kapsidě viru do hostitelské buňky.
Svým nejnovějším výzkumem Evilevitch a postgraduální student fyziky David Bauer odhalili, že portál je více než jen kanál pro DNA. Je také nejslabší strukturní částí kapsidy.
„Nejzajímavější je, že jsme poprvé ukázali, jak tlak DNA ovlivňuje stabilitu portálu, což v konečném důsledku určuje stabilitu viru v průběhu času při jakékoli teplotě,“ řekl Evilevitch, docent fyziky a člen Centra pro mechaniku a inženýrství buněčných systémů CMU.
Portál je kritickou součástí virových kapsid. Komplex portálu, který se skládá z několika různých proteinů, aktivně balí DNA během sestavování viru, uvolňuje DNA během infekce a, jak ukazuje nový výzkum, je klíčem k udržení křehké rovnováhy kapsidy, která je dostatečně stabilní, aby udržela genom, a zároveň dostatečně nestabilní, aby umožnila účinné uvolnění genomu během infekce.
„Předchozí experimenty zkoumaly roli vnitřního tlaku na strukturální integritu virových kapsid,“ řekl Evilevitch. „Zde přinášíme první experimentální důkaz, že je to právě mechanická pevnost samotného portálového komplexu, která určuje stabilitu viru s ohledem na udržení genomu.“
„Nejzajímavější je, že jsme poprvé ukázali, jak tlak DNA ovlivňuje stabilitu portálu, což v konečném důsledku určuje stabilitu viru v průběhu času při jakékoli teplotě.“ – Alex Evilevitch
Pro tuto studii se Evilevitch a jeho tým zabývali stabilitou portálního komplexu u tří různých virů – dvou virů, které infikují bakterie (Lambda a P22), a jednoho, který infikuje lidské buňky (HSV-1). Všechny tři viry obsahují dvouvláknovou DNA, která vyvíjí tlak na stěnu kapsidy.
Pomocí nového testu diferenční skenovací mikrokalorimetrie, který vyvinuli, vědci zahřívali vzorky virů a zjišťovali teplotu, při které se portál otevírá a uvolňuje DNA. Tato teplota odráží mechanickou stabilitu portálu.
Pro každý typ viru, který studovali, vytvořili vědci mutantní kmeny daného viru tak, že měnili délku zabalené DNA uvnitř, čímž vytvořili mutanty s různým vnitřním tlakem. Výsledky testů ukázaly, že mutanti s větší délkou zabalené DNA, a tedy s větším tlakem, uvolňovali svou DNA portálem při nižší teplotě. Toto zjištění naznačuje, že mechanická síla genomu tlačícího na portál viru jej destabilizuje a činí jej náchylným k rozbití.
Výzkumný tým navíc porovnal teplotu uvolňování DNA u tří různých typů virů. Výsledky odhalily zvýšení stability portálu u virů, které mají delší genomy, a proto je v nich vyšší tlak.
„Naše výsledky naznačují, že portálový komplex se vyvinul tak, aby odolal vnější síle zabaleného genomu vyvážené požadavkem na účinné uvolnění DNA během infekce,“ uvedl Evilevitch. „Další pochopení této rovnováhy mezi vnitřním tlakem a stabilitou portálu nabízí nové poznatky pro zasahování do virové replikace a také pro navrhování virových vektorů pro genovou terapii, které mohou stabilně uchovávat cizí nukleovou kyselinu.“
Kromě Evilevičové a Bauera se na projektu podílejí i další vědci: Dong Li z CMU, Fred Homa a Jamie Huffman z University of Pittsburgh School of Medicine, Kasandra Wilson, Justin Leavitt a Sherwood Casjens z University of Utah School of Medicine a Joel Baines z Louisiana State University School of Veterinary Medicine.
Tento výzkum byl financován Švédskou výzkumnou radou a Národní vědeckou nadací (CHE-1152770 pro AE) s další podporou grantů Služby veřejného zdraví a grantu na školení Národního ústavu zdraví.
.