9.4: Proč nevidíme molekuly?
Nejjednodušší způsob, jak určit strukturu molekul, by bylo „vidět“, jak jsou uspořádána jádra a jak jsou rozloženy elektrony. To není možné pomocí viditelného světla, protože vlnové délky viditelného světla jsou mnohem delší než obvyklé rozměry molekul. Svazek elektronů může mít potřebné krátké vlnové délky, ale malé organické molekuly se ozářením elektrony o vhodných vlnových délkách rychle zničí. Přesto je elektronová mikroskopie cennou technikou pro studium velkých molekul, jako je DNA, které lze před zobrazením obarvit atomy těžkých kovů nebo jsou samy o sobě vůči svazku elektronů poměrně stabilní (obr. 9-4 a 9-5).

Prakticky všechny části spektra elektromagnetického záření, od rentgenového záření lo rádiové vlny, mají určité praktické využití při studiu organických molekul. Zvláště cenné je využití rentgenové difrakce pro určování struktury molekul v krystalech a v posledních deseti letech se tato technika stala téměř rutinní. Obrázek 9-6 ukazuje podrobné uspořádání uhlíků, vodíků a bromů v 1,8-bis(brommethyl)naftalenu, \(1\), jak bylo určeno pomocí rentgenové difrakce. Použité přístroje a techniky jsou velmi složité a zatím nejsou dostupné pro mnoho organických laboratoří.\(^3\)
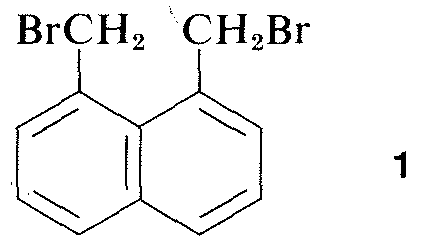
Další difrakční metody zahrnují elektronovou difrakci, kterou lze použít k určení struktury plynů nebo těkavých kapalných látek, které nelze získat jako krystaly vhodné pro rentgenovou difrakci, a neutronovou difrakci, která má zvláštní použití pro krystaly, u nichž je požadováno přesné umístění vodíků. Vodík nemá dostatečnou rozptylovou sílu pro přesnou lokalizaci rentgenového záření pomocí rentgenové difrakce.
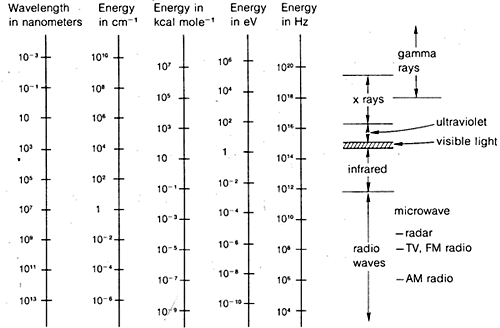
Difrakční metody lze použít k určení úplné struktury organických molekul, ale nejsou dostatečně rutinní, aby se daly obecně využít v praktické organické laboratorní práci. Z tohoto důvodu budeme ve zbytku této kapitoly klást důraz na ty formy spektroskopie, které jsou běžně dostupné pro rutinní laboratorní použití. Jak uvidíme, tyto metody používají organičtí chemici více či méně empirickým způsobem. Obecně platí, že spektroskopické metody závisí na určité formě excitace molekul absorpcí elektromagnetického záření, a jak jsme již řekli, prakticky všechny části elektromagnetického spektra jsou v tomto ohledu užitečné. Běžně používané rozpětí elektromagnetického spektra je uvedeno na obrázku 9-7 spolu s porovnáním různých jednotek, které se používají pro vyjádření energie nebo vlnové délky.
Hlavní druhy spektroskopie používané pro strukturní analýzu organických sloučenin jsou uvedeny v tabulce 9-1. Je zde uveden rozsah frekvencí absorbovaného záření, účinek vyvolaný zářením a specifický druh informace, která se využívá při strukturní analýze. Po stručném popisu principů spektroskopie popíšeme metody, které jsou pro praktickou laboratorní práci nejužitečnější. Přesto je velmi důležité znát i další, méně rutinní metody, které lze použít k řešení speciálních problémů, a některé z nich jsou probrány v této kapitole a v kapitolách 19 a 27.
Možná budete mít problémy se vztahy mezi různými jednotkami vlnové délky a frekvence, které se ve spektroskopii běžně používají. Vztah mezi vlnovou délkou, frekvencí a rychlostí by vám měl být jasný, když si představíte, že stojíte na molu a pozorujete proplouvající mořské vlny. Za předpokladu, že jsou vlny rovnoměrně rozmístěny, bude mezi jejich hřebeny stejná vzdálenost, která je \(\lambda\), což je vlnová délka. Hřebeny vln se budou míhat určitým počtem za minutu, což je \(\nu\), frekvence. Rychlost, \(c\), kterou se hřebeny vln pohybují kolem vás, souvisí s \(\lambda\) a \(\nu\) podle vztahu \(c = \lambda \nu\).
Toto není příliš složité a platí to stejně dobře pro vodní vlny nebo elektromagnetické záření. Co je téměř zbytečně komplikované, je množství jednotek běžně používaných k vyjádření \(\lambda\) a \(\nu\) pro elektromagnetické záření. Jedním problémem je tradice, druhým snaha vyhnout se velmi velkým nebo velmi malým číslům. Jak ukazuje obrázek 9-7, mohou nás zajímat vlnové délky elektromagnetického záření, které se liší až o faktor \(10^{16}\). Protože rychlost elektromagnetického záření ve vakuu je konstantní a činí \(3 \krát 10^8 \: \text{m sec}^{-1}\), budou se frekvence lišit o stejný faktor.
Běžně používané jednotky pro vlnovou délku jsou metry (\(\text{m}\)), centimetry (\(\text{cm}\)), nanometry (\(\text{nm}\) a mikrony (\(\mu\)). V minulosti se poměrně často používaly také angstromy (\(Å\)) a milimikrony (\(\text{m} \mu m\)).
\
\
\
\
Frekvenční jednotky jsou v cyklech za sekundu (cps) nebo v hertzích (\(\text{Hz}\), které jsou ekvivalentní (radiány za sekundu jsou široce používány fyziky).
Tabulka 9-1: Hlavní spektroskopické techniky používané v současnosti pro analýzu molekulární struktury

\
\
\
\
\(^3\)Užitečný popis toho, jak lze molekulární strukturu určit pomocí „rentgenového vidění“, je uveden v kapitole XI knihy Organic Molecules in Action od M. Goodman a F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert a Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, druhé vydání. W. A. Benjamin, Inc. , Menlo Park, Kalifornie. ISBN 0-8053-8329-8. Tento obsah je chráněn autorskými právy za následujících podmínek: „Je vám uděleno povolení k individuálnímu, vzdělávacímu, výzkumnému a nekomerčnímu rozmnožování, šíření, zobrazování a předvádění tohoto díla v jakémkoli formátu.“