9.4: Varför kan vi inte se molekyler?
Det enklaste sättet att bestämma molekylers strukturer skulle vara att ”se” hur atomkärnorna är arrangerade och hur elektronerna är fördelade. Detta är inte möjligt med synligt ljus, eftersom det synliga ljusets våglängder är mycket mycket längre än de vanliga molekylära dimensionerna. En elektronstråle kan ha de korta våglängder som krävs, men små organiska molekyler förstörs snabbt vid bestrålning med elektroner med rätt våglängd. Trots detta är elektronmikroskopi en värdefull teknik för att studera stora molekyler, t.ex. DNA, som kan färgas med tungmetallatomer innan de betraktas, eller som i sig själva är någorlunda stabila mot en elektronstråle (figurerna 9-4 och 9-5).

Nästan alla delar av den elektromagnetiska strålningens spektrum, från röntgenstrålar till radiovågor, har någon praktisk tillämpning för studiet av organiska molekyler. Användningen av röntgendiffraktion för att bestämma strukturen hos molekyler i kristaller är av särskilt värde, och under de senaste tio åren har denna teknik blivit nästan rutinmässig. Figur 9-6 visar det detaljerade arrangemanget av kolväten, väteämnen och bromer i 1,8-bis(bromometyl)naftalen, \(1\), som bestämts genom röntgendiffraktion. De apparater och tekniker som används är mycket komplexa och är ännu inte tillgängliga för särskilt många organiska laboratorier.\(^3\)
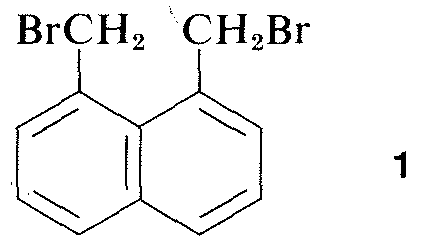
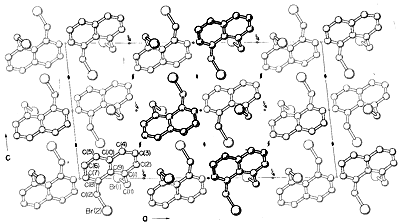
Andra diffraktionsmetoder inkluderar elektrondiffraktion, som kan användas för att bestämma strukturen hos gaser eller flyktiga flytande substanser som inte kan erhållas i form av kristaller som lämpar sig för röntgendiffraktion, och neutron diffraktion, som är särskilt användbar för kristaller där man vill ha en exakt lokalisering av väteämnen. Väte har inte tillräcklig spridningsförmåga för att röntgenstrålar ska kunna lokaliseras exakt med hjälp av röntgendiffraktion.
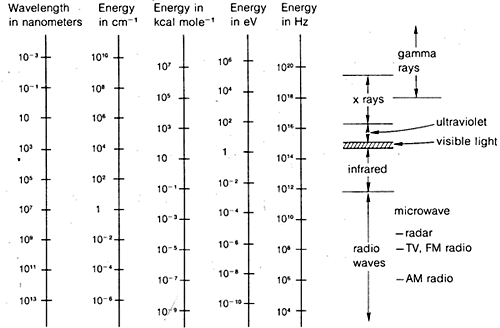
Diffraktionsmetoderna kan användas för att bestämma kompletta strukturer av organiska molekyler, men de är inte tillräckligt rutinmässiga för att användas generellt i praktiskt organiskt laboratoriearbete. Av denna anledning kommer vi i resten av detta kapitel att betona de former av spektroskopi som är allmänt tillgängliga för rutinmässig laboratorieanvändning. Som vi kommer att se används dessa metoder av organiska kemister på mer eller mindre empiriska sätt. I allmänhet är spektroskopiska metoder beroende av någon form av excitation av molekyler genom absorption av elektromagnetisk strålning och, som vi har sagt, har praktiskt taget alla delar av det elektromagnetiska spektrumet nytta i detta avseende. Det vanligt förekommande spannet av det elektromagnetiska spektrumet visas i figur 9-7 tillsammans med en jämförelse av de olika enheter som används för att uttrycka energi eller våglängd.
De viktigaste typerna av spektroskopi som används för strukturell analys av organiska föreningar är listade i tabell 9-1. Frekvensområdet för den absorberade strålningen visas, liksom den effekt som strålningen ger upphov till och den specifika typ av information som används i strukturanalysen. Efter en kort redogörelse för spektroskopins principer kommer vi att beskriva de metoder som är av störst nytta för praktiskt laboratoriearbete. Trots detta är det mycket viktigt att känna till de andra, mindre rutinmässiga, metoder som kan användas för att lösa speciella problem, och några av dessa diskuteras i detta kapitel och i kapitel 19 och 27.
Du kan ha problem med relationerna mellan de olika våglängds- och frekvensenheter som vanligen används vid spektroskopi. Förhållandet mellan våglängd, frekvens och hastighet bör bli tydligt för dig om du tänker dig att du står på en pir och tittar på havets vågor som går förbi. Om man antar att vågorna är jämnt fördelade kommer det att finnas ett jämnt avstånd mellan topparna, vilket är \(\lambda\), våglängden. Vågkullarna kommer att passera med ett visst antal per minut, vilket är \(\nu\), frekvensen. Hastigheten, \(c\), med vilken vågkullarna rör sig förbi dig är relaterad till \(\lambda\) och \(\nu\) genom förhållandet \(c = \lambda \nu\).
Detta är egentligen inte särskilt komplicerat och det gäller lika bra för vattenvågor som för elektromagnetisk strålning. Det som är nästan onödigt komplicerat är de olika enheter som vanligen används för att uttrycka \(\lambda\) och \(\nu\) för elektromagnetisk strålning. Det ena problemet är traditionen, det andra är önskan att undvika mycket stora eller mycket små tal. Som figur 9-7 visar kan vi alltså vara intresserade av elektromagnetiska våglängder som skiljer sig åt med så mycket som en faktor \(10^{16}\). Eftersom den elektromagnetiska strålningens hastighet i ett vakuum är konstant \(3 \ gånger 10^8 \: \text{m sec}^{-1}\), kommer frekvenserna att skilja sig åt med samma faktor.
Enheter som vanligen används för våglängd är meter (\(\text{m}\)), centimeter (\(\text{cm}\)), nanometer (\(\(\text{nm}\)) och mikrometer (\(\mu\)). Tidigare användes även angströmmar (\(Å\)) och millimikroner (\(\text{m} \mu m\)) i ganska stor utsträckning.
\
\
\
\
Frekvensenheter är i cykler per sekund (cps) eller hertz (\(\text{Hz}\)), som är likvärdiga (radianer per sekund används allmänt av fysiker).
Tabell 9-1: Huvudsakliga spektroskopiska tekniker som för närvarande används för analys av molekylstruktur

\
\
\
\(^3\)En användbar beskrivning av hur molekylära strukturer kan bestämmas med hjälp av ”röntgensyn” ges i kapitel XI i Organic Molecules in Action av M. Goodman och F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert och Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, andra upplagan. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Detta innehåll är upphovsrättsligt skyddat enligt följande villkor: ”Du beviljas tillstånd för individuell, pedagogisk, forskningsmässig och icke-kommersiell reproduktion, distribution, visning och framförande av detta verk i vilket format som helst.”