Știri
20 iulie, 2015
Dezvăluirile oferă o nouă țintă potențială pentru a interfera cu ciclul de viață al virusurilor
De Jocelyn Duffy / 412-268-9982 / [email protected]
Toți virușii au învelișuri de rezistență industrială care înconjoară și protejează materialul genetic din interior, permițând particulelor virale să rămână stabile, infecțioase și capabile să se răspândească. Biofizicianul Alex Evilevitch de la Universitatea Carnegie Mellon și colegii săi au identificat acum călcâiul lui Ahile al acestui înveliș rezistent.
Publicate în Journal of Virology, cea mai importantă revistă din domeniu, descoperirile identifică cea mai slabă parte a învelișului viral și oferă o nouă țintă potențială pentru a interfera cu ciclul de viață viral și pentru a dezvolta vehicule stabile de livrare a terapiei genetice.
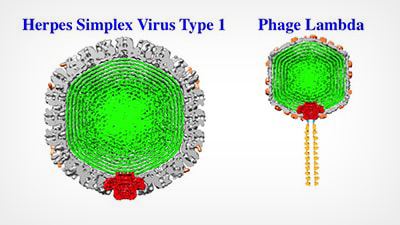
Virusurile precum Herpes Simplex 1 și Phage Lambda au învelișuri exterioare rezistente (gri) care înglobează și protejează ADN-ul viral (verde). Alex Evilevitch și colegii săi au identificat acum călcâiul lui Ahile al acestui înveliș dur, portalul viral (roșu). Imaginile de mai sus sunt reconstrucții Cryo EM; schema portalului este suprapusă.
Învelișul exterior, numit capsidă, înglobează materialul genetic al unui virus. Viruși precum virusul Herpes Simplex de tip 1 (HSV-1) conțin ADN bicatenar, ale cărui șiruri lungi sunt strâns împachetate și exercită o presiune imensă, care ajunge la zeci de atmosfere, asupra peretelui interior al capsidei. În lucrări anterioare, Evilevitch a măsurat pentru prima dată această presiune în HSV-1; el a arătat, de asemenea, că această presiune este cea care propulsează ADN-ul în afara unui mic portal din capsida virusului și în celula gazdă.
Cu cele mai recente cercetări ale sale, Evilevitch și studentul absolvent de fizică David Bauer dezvăluie că portalul este mai mult decât o simplă conductă pentru ADN. Este, de asemenea, cea mai slabă parte structurală a capsidei.
„Cel mai interesant lucru aici este că am arătat, pentru prima dată, modul în care presiunea ADN-ului afectează stabilitatea portalului, care în cele din urmă determină stabilitatea virusului în timp, la orice temperatură”, a declarat Evilevitch, profesor asociat de fizică și membru al Centrului pentru mecanica și ingineria sistemelor celulare de la CMU.
Portalul este o componentă critică a capsidelor virale. Alcătuit din mai multe proteine diferite, complexul portal împachetează în mod activ ADN-ul în timpul asamblării virale, eliberează ADN-ul în timpul infecției și, după cum relevă noile cercetări, este esențial pentru menținerea echilibrului delicat al capsidei de a fi suficient de stabilă pentru a reține genomul, fiind în același timp suficient de instabilă pentru a permite eliberarea eficientă a genomului în timpul infecției.
„Experimentele anterioare au investigat rolul presiunii interne asupra integrității structurale a capsidelor virale”, a spus Evilevitch. „Aici furnizăm prima dovadă experimentală că rezistența mecanică a complexului portal în sine este cea care determină stabilitatea virusului în ceea ce privește reținerea genomului.”
„Cel mai interesant lucru aici este că am arătat, pentru prima dată, modul în care presiunea ADN-ului afectează stabilitatea portalului, care în cele din urmă determină stabilitatea virusului în timp, la orice temperatură.” – Alex Evilevitch
Pentru acest studiu, Evilevitch și echipa sa au analizat stabilitatea complexului portal în trei, virusuri diferite – două virusuri care infectează bacteriile (Lambda și P22) și unul care infectează celulele umane (HSV-1). Toate cele trei virusuri conțin ADN dublu catenar care exercită o presiune asupra peretelui capsidei.
Utilizând un nou test de microcalorimetrie cu scanare diferențială pe care l-au dezvoltat, cercetătorii au încălzit probele de virus și au detectat temperatura la care portalul se deschide pentru a elibera ADN-ul. Această temperatură reflectă stabilitatea mecanică a portalului.
Pentru fiecare tip de virus pe care l-au studiat, cercetătorii au creat tulpini mutante ale acelui virus prin variația lungimii ADN-ului împachetat în interior, creând astfel mutanți cu presiuni interne diferite. Rezultatele testelor au arătat că mutanții cu mai mult ADN împachetat și, prin urmare, cu o presiune mai mare, și-au eliberat ADN-ul prin portal la o temperatură mai scăzută. Această constatare sugerează că forța mecanică a genomului care împinge împotriva portalului virusului îl destabilizează și îl face predispus să se deschidă.
În plus, echipa de cercetare a comparat temperatura de eliberare a ADN-ului pentru cele trei tipuri diferite de virus. Rezultatele au evidențiat o creștere a stabilității portalului pentru virusurile care au genomuri mai lungi și, prin urmare, au presiuni mai mari în interior.
„Rezultatele noastre sugerează că complexul portal a evoluat pentru a rezista la forța exterioară a genomului împachetat, echilibrată cu cerința de eliberare eficientă a ADN-ului în timpul infecției”, a spus Evilevitch. „O înțelegere mai aprofundată a acestui echilibru între presiunea internă și stabilitatea portalului oferă noi perspective pentru a interfera cu replicarea virală, precum și pentru a proiecta vectori virali pentru terapia genică care pot reține în mod stabil acidul nucleic străin.”
Pe lângă Evilevitch și Bauer, printre cercetătorii implicați în proiect se numără: Dong Li de la CMU; Fred Homa și Jamie Huffman de la University of Pittsburgh School of Medicine; Kasandra Wilson, Justin Leavitt și Sherwood Casjens de la University of Utah School of Medicine; și Joel Baines de la Louisiana State University School of Veterinary Medicine.
Acest studiu a fost finanțat de Consiliul Suedez de Cercetare și de Fundația Națională de Știință (CHE-1152770 către AE), cu sprijin suplimentar din partea granturilor Serviciului de Sănătate Publică și a unui grant de formare al Institutului Național de Sănătate.
.