9.4: Porque não podemos ver moléculas?
A forma mais simples de determinar as estruturas das moléculas seria “ver” como os núcleos estão dispostos e como os electrões estão distribuídos. Isto não é possível com a luz visível, porque os comprimentos de onda da luz visível são muito mais longos do que as dimensões moleculares usuais. Um feixe de elétrons pode ter os comprimentos de onda curtos necessários, mas pequenas moléculas orgânicas são destruídas rapidamente pela irradiação com elétrons dos comprimentos de onda adequados. No entanto, a microscopia eletrônica é uma técnica valiosa para o estudo de moléculas grandes, como o DNA, que podem ser coradas com átomos de metais pesados antes da visualização, ou são elas próprias razoavelmente estáveis a um feixe de elétrons (Figuras 9-4 e 9-5).

Virtualmente todas as partes do espectro de radiação eletromagnética, a partir de ondas de rádio de raios x lo, têm alguma aplicação prática para o estudo de moléculas orgânicas. O uso da difração de raios-x para determinação das estruturas das moléculas em cristais é de particular valor, e nos últimos dez anos esta técnica tornou-se quase rotineira. A Figura 9-6 mostra a disposição detalhada dos carbonos, hidrogênios e bromo em 1,8-bis(bromometil)naftaleno, como determinado pela difração de raios-x. Os aparelhos e técnicas usadas são altamente complexos e ainda não estão disponíveis para muitos laboratórios orgânicos.\(^3\)
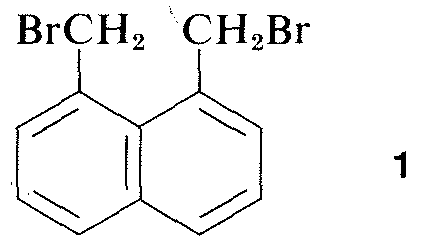
Outros métodos de difração incluem difração de elétrons, que podem ser usados para’determinar as estruturas de gases ou de substâncias líquidas voláteis que não podem ser obtidas como cristais adequados para difração de raios-x, e difração de nêutrons, que tem aplicação especial para cristais nos quais a localização exata dos hidrogênios é desejada. O hidrogênio não tem poder de dispersão suficiente para que os raios X sejam localizados precisamente por difração de raios X.
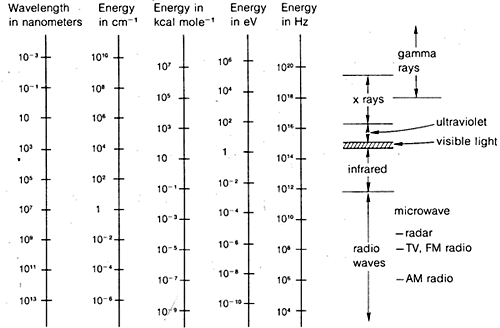
Os métodos de difração podem ser usados para determinar estruturas completas de moléculas orgânicas, mas não são suficientemente rotineiros para serem utilizados geralmente no trabalho prático de laboratório orgânico. Por esta razão, no restante deste capítulo vamos enfatizar aquelas formas de espectroscopia que estão geralmente disponíveis para uso laboratorial de rotina. Como será visto, estes métodos são usados por químicos orgânicos de maneiras mais ou menos empíricas. Em geral, os métodos espectroscópicos dependem de alguma forma de excitação de moléculas por absorção de radiação eletromagnética e, como já dissemos, praticamente todas as partes do espectro eletromagnético têm utilidade a esse respeito. O intervalo do espectro eletromagnético comumente usado é mostrado na Figura 9-7, juntamente com uma comparação das várias unidades que são empregadas para expressar energia ou comprimento de onda.
Os principais tipos de espectroscopia usados para análise estrutural de compostos orgânicos estão listados na Tabela 9-1. A gama de frequências da radiação absorvida é mostrada, assim como o efeito produzido pela radiação e o tipo específico de informação que é utilizada na análise estrutural. Após um breve relato dos princípios da espectroscopia, vamos descrever os métodos que são de maior utilidade para o trabalho prático em laboratório. No entanto, é muito importante estar atento aos outros métodos, menos rotineiros, que podem ser usados para resolver problemas especiais, e alguns destes são discutidos neste capítulo e nos Capítulos 19 e 27.
Você pode ter problemas com as relações entre a variedade de unidades de comprimento de onda e frequência comumente usadas na espectroscopia. A relação entre comprimento de onda, frequência e velocidade deve tornar-se clara para você, considerando que você está em um píer observando as ondas do oceano passando. Assumindo que as ondas estão uniformemente espaçadas, haverá uma distância uniforme entre as cristas, que é o comprimento de onda. As cristas de onda passarão a um certo número por minuto, que é a frequência. A velocidade, c = lambda, em que as cristas se movem por si está relacionada com a lambda e a relação c = lambdanu).
Isto não é realmente muito complicado e aplica-se igualmente bem a ondas de água ou radiação electromagnética. O que é quase desnecessariamente complicado é a variedade de unidades comumente usadas para expressar a radiação eletromagnética. Um problema é a tradição, o outro é o desejo de evitar números muito grandes ou muito pequenos. Assim, como mostra a Figura 9-7, podemos estar interessados em comprimentos de onda eletromagnéticos que diferem tanto quanto um fator de ^(10^{16}). Como a velocidade da radiação eletromagnética no vácuo é constante em 3 vezes 10^8, as freqüências diferem pelo mesmo fator.
Unidades comumente usadas para comprimento de onda são metros (texto (m)), centímetros (cm), nanômetros (m), e micrômetros (m)). No passado, angstroms (ÅÅ)) e milimicrons (Åmu m)) também eram usados bastante amplamente.
>
>
>
>
Unidades de frequência estão em ciclos por segundo (cps) ou hertz (\i(\i(\i(\i(\i(\i(\i(\i(\i(\i(}))), que são equivalentes (os radianos por segundo são amplamente utilizados pelos físicos).
Tabela 9-1: Principais Técnicas Espectroscópicas Atualmente em Uso para Análise da Estrutura Molecular

>
>
>
(^3})Uma descrição útil de como as estruturas moleculares podem ser determinadas pela “visão raio-x” é dada no Capítulo XI de Moléculas Orgânicas em Acção de M. Goodman e F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert e Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, segunda edição. W. A. Benjamin, Inc. (1977) , Menlo Park, CA. ISBN 0-8053-8329-8. Este conteúdo está protegido por direitos autorais sob as seguintes condições: “Você tem permissão para reprodução, distribuição, exibição e execução individual, educacional, de pesquisa e não-comercial deste trabalho em qualquer formato”