Nieuws
juli 20, 2015
Vindingen bieden potentieel nieuw doelwit om in de virale levenscyclus in te grijpen
Door Jocelyn Duffy / 412-268-9982 / [email protected]
Alle virussen hebben een industrieel sterk omhulsel dat het genetisch materiaal binnenin omhult en beschermt, waardoor de virale deeltjes stabiel, besmettelijk en in staat om zich te verspreiden kunnen blijven. Carnegie Mellon University biofysicus Alex Evilevitch en collega’s hebben nu de achilleshiel van die taaie schaal geïdentificeerd.
gepubliceerd in het Journal of Virology, het belangrijkste tijdschrift op dit gebied, geven de bevindingen het zwakste deel van de virale schaal aan en bieden een potentieel nieuw doelwit voor het verstoren van de virale levenscyclus en voor het ontwikkelen van stabiele gentherapie-afleveringsmiddelen.
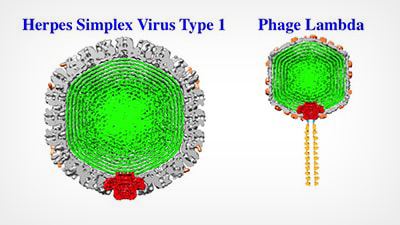
Virussen zoals Herpes Simplex 1 en Phage Lambda hebben harde buitenmantels (grijs) die het virale DNA (groen) omhullen en beschermen. Alex Evilevitch en collega’s hebben nu de achilleshiel van die taaie schil geïdentificeerd, het virale portaal (rood). Bovenstaande afbeeldingen zijn Cryo EM-reconstructies; het portaalschema is gesuperponeerd.
De buitenste schil, capsid genoemd, omsluit het genetisch materiaal van een virus. Virussen zoals Herpes Simplex virus type 1 (HSV-1) bevatten dubbelstrengs DNA, waarvan de lange strengen dicht opeengepakt zijn en een enorme hoeveelheid druk uitoefenen, die tientallen atmosferen kan bereiken, op de inwendige capside wand. In eerder werk heeft Evilevitch voor het eerst deze druk gemeten in HSV-1; hij heeft ook aangetoond dat het deze druk is die DNA uit een klein portaal in de capsule van het virus en in een gastheercel stuwt.
Met zijn laatste onderzoek onthullen Evilevitch en natuurkundestudent David Bauer dat het portaal meer is dan alleen een doorvoer voor DNA. Het is ook het zwakste structurele deel van de capsid.
“Het meest opwindende hier is dat we voor het eerst hebben aangetoond hoe de druk van het DNA de stabiliteit van het portaal beïnvloedt, wat uiteindelijk de stabiliteit van het virus bepaalt in de tijd bij elke temperatuur,” zei Evilevitch, universitair hoofddocent natuurkunde en lid van CMU’s Center for the Mechanics and Engineering of Cellular Systems.
Het portaal is een kritisch onderdeel van virale capsids. Het portaalcomplex, dat uit verschillende eiwitten bestaat, verpakt actief DNA tijdens virale assemblage, laat DNA los tijdens infectie en, zoals het nieuwe onderzoek onthult, is de sleutel tot het handhaven van de delicate balans van de capside van stabiel genoeg zijn om het genoom te behouden, terwijl het instabiel genoeg is om efficiënt vrijkomen van het genoom tijdens infectie mogelijk te maken.
“Eerdere experimenten hebben de rol van interne druk op de structurele integriteit van virale capsiden onderzocht,” zei Evilevitch. “Hier leveren we het eerste experimentele bewijs dat het de mechanische sterkte van het portaalcomplex zelf is dat de stabiliteit van het virus bepaalt met betrekking tot genoomretentie.”
“Het meest opwindende hier is dat we voor het eerst hebben aangetoond hoe DNA-druk de portaalstabiliteit beïnvloedt, die uiteindelijk de stabiliteit van het virus in de tijd bepaalt bij elke temperatuur.” – Alex Evilevitch
Voor deze studie keken Evilevitch en zijn team naar de portaalcomplexstabiliteit in drie verschillende, virussen – twee virussen die bacteriën infecteren (Lambda en P22) en een die menselijke cellen infecteert (HSV-1). Alle drie de virussen bevatten dubbelstrengs DNA dat druk uitoefent op de capside wand.
Met behulp van een nieuwe differentiële scanning microcalorimetrie assay die zij ontwikkelden, verwarmden de onderzoekers de virusmonsters en detecteerden de temperatuur waarbij het portaal zich opent om DNA vrij te geven. Die temperatuur weerspiegelt de mechanische stabiliteit van het portaal.
Voor elk type virus dat zij bestudeerden, creëerden de onderzoekers mutantstammen van dat virus door de lengte van het verpakte DNA binnenin te variëren, waardoor mutanten met verschillende interne druk werden gecreëerd. De resultaten van de proeven toonden aan dat mutanten met meer verpakt DNA en dus meer druk, hun DNA bij een lagere temperatuur via het portaal vrijgaven. Deze bevinding suggereert dat de mechanische kracht van het genoom dat tegen het portaal van het virus duwt, het destabiliseert en het vatbaar maakt voor openbreken.
Daarnaast vergeleek het onderzoeksteam de temperatuur van de DNA-afgifte voor de drie verschillende virustypes. De resultaten onthulden een toename in de portaalstabiliteit voor virussen die langere genomen hebben en daardoor een hogere druk binnenin hebben.
“Onze resultaten suggereren dat het portaalcomplex is geëvolueerd om de naar buiten gerichte kracht van het verpakte genoom te weerstaan, afgewogen tegen de vereiste van efficiënte DNA-afgifte tijdens infectie,” zei Evilevitch. “Verder inzicht in dit evenwicht tussen interne druk en portaalstabiliteit biedt nieuwe inzichten voor het verstoren van virale replicatie, evenals het ontwerpen van virale vectoren voor gentherapie die stabiel vreemd nucleïnezuur kunnen vasthouden.”
Naast Evilevitch en Bauer, zijn bij het project betrokken onderzoekers onder meer: CMU’s Dong Li; de Universiteit van Pittsburgh School of Medicine’s Fred Homa en Jamie Huffman; de Universiteit van Utah School of Medicine’s Kasandra Wilson, Justin Leavitt en Sherwood Casjens; en Louisiana State University School of Veterinary Medicine’s Joel Baines.
Dit onderzoek werd gefinancierd door de Zweedse Onderzoeksraad en de National Science Foundation (CHE-1152770 aan AE) met aanvullende steun van de Public Health Service subsidies en een National Institutes of Health training grant.