9.4: Waarom kunnen we moleculen niet zien?
De meest eenvoudige manier om de structuur van moleculen te bepalen zou zijn om te “zien” hoe de kernen zijn gerangschikt en hoe de elektronen zijn verdeeld. Dit is niet mogelijk met zichtbaar licht, omdat de golflengten van zichtbaar licht veel langer zijn dan de gebruikelijke afmetingen van moleculen. Een bundel elektronen kan de vereiste korte golflengten hebben, maar kleine organische moleculen worden snel vernietigd door bestraling met elektronen met de juiste golflengten. Niettemin is elektronenmicroscopie een waardevolle techniek voor de bestudering van grote moleculen, zoals DNA, die met zware metaalatomen kunnen worden gekleurd voordat ze worden bekeken, of die zelf redelijk stabiel zijn voor een elektronenbundel (figuren 9-4 en 9-5).

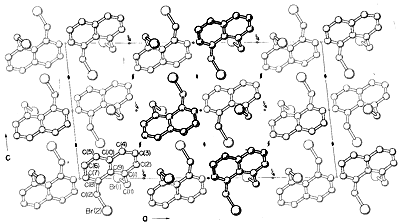
Virtueel alle delen van het spectrum van elektromagnetische straling, van röntgenstralen tot radiogolven, hebben een praktische toepassing voor de studie van organische moleculen. Het gebruik van röntgendiffractie voor de bepaling van de structuren van moleculen in kristallen is bijzonder waardevol, en in de afgelopen tien jaar is deze techniek bijna routine geworden. Figuur 9-6 toont de gedetailleerde rangschikking van de koolwaterstoffen, de hydrogenen en de broomgroepen in 1,8-bis(broommethyl)naftaleen, zoals bepaald door röntgendiffractie. De gebruikte apparatuur en technieken zijn zeer complex en zijn nog niet beschikbaar voor zeer veel organische laboratoria.
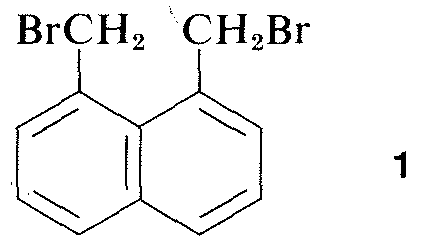
Andere diffractiemethoden zijn elektronendiffractie, die kan worden gebruikt om de structuren te bepalen van gassen of van vluchtige vloeibare stoffen die niet kunnen worden verkregen als kristallen die geschikt zijn voor röntgendiffractie, en neutronendiffractie, die een speciale toepassing heeft voor kristallen waarin de exacte plaats van de waterstofgenen gewenst is. Waterstof heeft niet voldoende verstrooiend vermogen om met röntgendiffractie nauwkeurig gelokaliseerd te worden.
De diffractiemethoden kunnen worden gebruikt om volledige structuren van organische moleculen te bepalen, maar zij zijn niet routineus genoeg om algemeen te worden gebruikt in praktisch organisch laboratoriumwerk. Daarom zullen we in de rest van dit hoofdstuk de nadruk leggen op die vormen van spectroscopie die algemeen beschikbaar zijn voor routinematig laboratoriumgebruik. Zoals zal blijken, worden deze methoden door organisch scheikundigen op min of meer empirische wijze gebruikt. In het algemeen zijn spectroscopische methoden afhankelijk van een of andere vorm van excitatie van moleculen door absorptie van elektromagnetische straling en, zoals gezegd, zijn vrijwel alle delen van het elektromagnetische spectrum in dit opzicht bruikbaar. De meest gebruikte delen van het elektromagnetische spectrum zijn weergegeven in figuur 9-7, samen met een vergelijking van de verschillende eenheden die worden gebruikt om energie of golflengte uit te drukken.
De belangrijkste soorten spectroscopie die worden gebruikt voor de structurele analyse van organische verbindingen zijn vermeld in tabel 9-1. Het bereik van de frequenties van de geabsorbeerde straling wordt aangegeven, evenals het door de straling veroorzaakte effect en het specifieke soort informatie dat bij de structurele analyse wordt gebruikt. Na een korte uiteenzetting over de beginselen van spectroscopie, zullen wij de methoden beschrijven die van het grootste nut zijn voor praktisch laboratoriumwerk. Niettemin is het van groot belang op de hoogte te zijn van de andere, minder routinematige, methoden die kunnen worden gebruikt om speciale problemen op te lossen, en enkele daarvan worden in dit hoofdstuk en in de hoofdstukken 19 en 27 besproken.
Je kunt problemen hebben met de relaties tussen de verscheidenheid aan golflengte- en frequentie-eenheden die gewoonlijk in de spectroscopie worden gebruikt. Het verband tussen golflengte, frequentie en snelheid zou u duidelijk moeten worden door uzelf voor te stellen dat u op een pier staat te kijken naar voorbijtrekkende oceaangolven. Ervan uitgaande dat de golven gelijkmatig verdeeld zijn, zal er een gelijkmatige afstand tussen de toppen zijn, die gelijk is aan de golflengte. De golftoppen komen met een bepaald aantal per minuut voorbij, dat is de frequentie. De snelheid, c, waarmee de golfkammen aan u voorbij trekken is gerelateerd aan c en de frequentie door de relatie c = c. Dit is eigenlijk niet zo ingewikkeld en het is net zo goed van toepassing op watergolven als op elektromagnetische straling. Wat bijna nodeloos ingewikkeld is, is de verscheidenheid aan eenheden die gewoonlijk worden gebruikt om de eenheden voor elektromagnetische straling uit te drukken. Het ene probleem is de traditie, het andere is de wens om zeer grote of zeer kleine getallen te vermijden. Zo kunnen wij, zoals figuur 9-7 laat zien, geïnteresseerd zijn in elektromagnetische golflengten die maar liefst een factor 10(16) van elkaar verschillen. Omdat de snelheid van de elektromagnetische straling in een vacuüm constant is (3 keer 10^8: \text{m sec}^{-1}), zullen de frequenties met dezelfde factor verschillen.
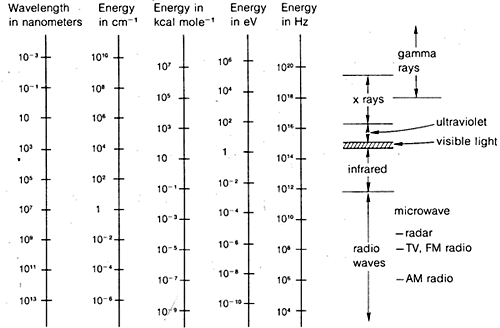
De eenheden die gewoonlijk voor de golflengte worden gebruikt zijn meters, centimeters, nanometers en microns. In het verleden werden angstroms (\)) en millimicrons (\)) ook vrij veel gebruikt.
Frequentie-eenheden zijn in cycli per seconde (cps) of hertz ((\text{Hz})), die equivalent zijn (radialen per seconde worden veel gebruikt door natuurkundigen).
Tabel 9-1: Belangrijkste spectroscopische technieken die momenteel worden gebruikt voor de analyse van de moleculaire structuur

(^3)Een nuttige beschrijving van hoe moleculaire structuren kunnen worden bepaald door “röntgenvisie” wordt gegeven in hoofdstuk XI van Organic Molecules in Action door M. Goodman and F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert and Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Deze inhoud is auteursrechtelijk beschermd onder de volgende voorwaarden: “You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format.”