Qu’est-ce que l’imagerie grand champ ?
Introduction
Toute technique de microscopie où l’ensemble de l’échantillon est exposé à la lumière est connue sous le nom d’imagerie » grand champ « . Le pendant du champ large est le confocal, où des trous d’épingle sont utilisés pour bloquer la plupart de la lumière vers et depuis l’échantillon. Cet article traite de l’imagerie à champ large et des techniques à champ large les plus utilisées en microscopie.
Microscopes à champ large
Dans un champ large, l’ensemble de l’échantillon est éclairé par une source lumineuse à lampe, soit par le bas (microscope droit), soit par le haut (microscope inversé). Les microscopes droits sont fréquemment utilisés avec des échantillons fixes tels que des cellules ou des tissus qui ont été traités et montés sur des lames de microscope, tandis que les microscopes inversés sont souvent plus adaptés à l’imagerie d’un échantillon immergé dans un liquide, car il coulerait typiquement au fond et serait plus facile à voir par le bas avec les objectifs du microscope. Cela permet l’imagerie de cellules en suspension, car les cellules étudiées dans les sciences de la vie sont généralement soit adhérentes (se développent attachées à une surface), soit en suspension (cellules en suspension dans un fluide). Des exemples de microscope droit et inversé peuvent être vus dans la Fig.1.
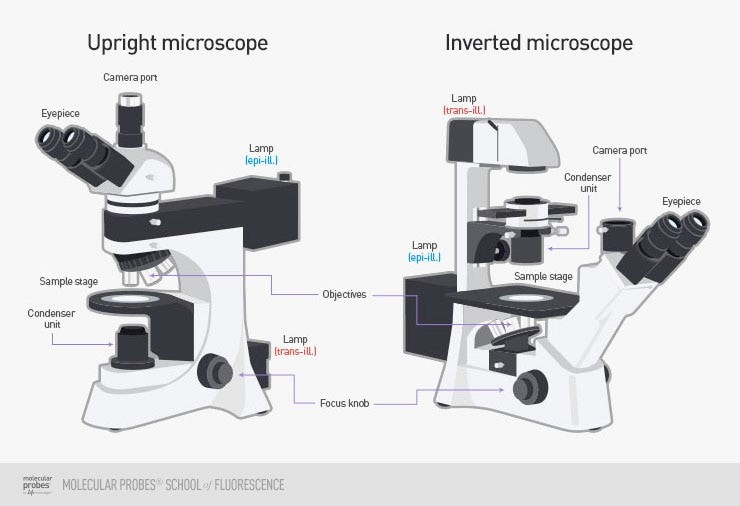
Les microscopes à grand champ utilisent généralement une source de lumière blanche (comme une lampe) est suffisante avec quelques filtres pour le travail de fluorescence. Cela rend également l’imagerie plus simple et la taille des fichiers d’image plus petite, ce qui facilite le travail avec le champ large pour des applications telles que la documentation cellulaire.
Techniques de champ large
Les exemples de techniques de microscopie à champ large sont le champ clair, le contraste interférentiel différentiel (DIC), le contraste de phase et la fluorescence à champ large.
La microscopie à champ clair est une forme accessible de microscopie, où un échantillon entier est éclairé par une lumière vive. Cette approche implique peu de préparation de l’échantillon et peut être utilisée pour vérifier rapidement et facilement des cellules vivantes ou pour produire des données supplémentaires. Cependant, l’utilisation d’un agent de contraste est fortement recommandée car la plupart des échantillons de cellules sont transparents et seront difficiles à résoudre sans colorant ou teinture. Les cellules sont principalement constituées d’eau et lorsqu’elles sont imagées sur du verre ou du plastique transparent, il peut être difficile de repérer les plus petites structures sans un certain contraste supplémentaire.
Pour le contraste interférentiel différentiel (DIC), l’échantillon est éclairé par une lumière divisée en deux faisceaux de lumière polarisée, lorsque ces faisceaux se recombinent, les différences de déphasage apparaissent comme un contraste dans l’image finale. De même que le contraste de phase, cette technique n’est pas adaptée aux échantillons plus épais et nécessite une configuration technique plus importante que les autres techniques.
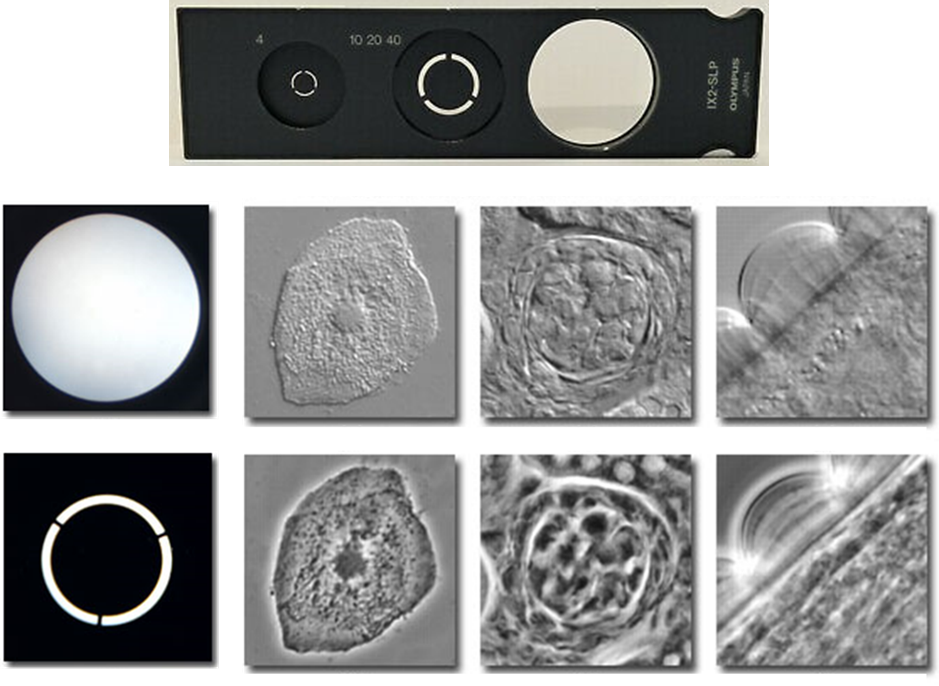
La microscopie à contraste de phase fournit un meilleur contraste que le fond clair en utilisant la lumière diffusée par l’échantillon. En éclairant l’échantillon avec un anneau de lumière et en ayant un autre anneau devant le viseur du microscope, les parties de l’échantillon qui diffusent la lumière différemment apparaissent comme plus sombres ou plus claires sur l’image, ce qui lui donne plus de contraste que la microscopie à fond clair standard. Ce contraste amélioré n’est pas visible sur les échantillons plus épais car il produit des artefacts, mais il fonctionne bien avec les cultures cellulaires. Un exemple de ces anneaux peut être vu dans la Fig.2.
La microscopie à fluorescence à champ large est similaire au champ clair mais des longueurs d’onde spécifiques de la lumière sont utilisées afin d’exciter des molécules fluorescentes avec lesquelles l’échantillon a été prétraité (bien que certains échantillons soient naturellement auto-fluorescents). Les échantillons peuvent être colorés avec des marqueurs fluorescents pour des protéines ou des composants cellulaires spécifiques, et la lumière d’émission de fluorescence de ces marqueurs forme alors une image. Le signal de fluorescence permet d’obtenir un meilleur contraste par rapport à d’autres techniques, car en utilisant des longueurs d’onde de lumière spécifiques, seules les molécules fluorescentes émettent de la lumière, alors que l’image entière est éclairée. Cependant, comme l’ensemble de l’échantillon est éclairé à l’aide de cette lumière, les signaux de fluorescence provenant de l’extérieur de la zone d’observation peuvent provoquer une fluorescence de fond et des images floues.
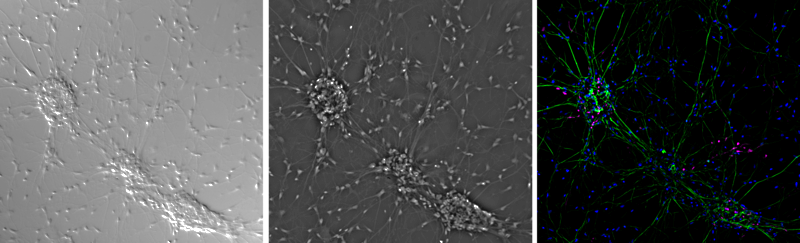
La lumière hors foyer
Le principal inconvénient est que lorsque l’ensemble de l’échantillon est éclairé, alors que le plan focal reçoit de la lumière et peutgénérer une image, les plans au-dessus et au-dessous du plan focal reçoivent également de la lumière, ce qui entraîne une lumière hors foyer provoquant une dégradation de l’image. En particulier pour l’excitation de fluorescence, la résolution d’un système à grand champ est limitée en raison de la fluorescence de fond qui est également capturée par la caméra et qui diminue le rapport signal/bruit.
Certaines techniques à grand champ évitent ce problème, comme la microscopie à illumination structurée (SIM), qui utilise des motifs de lumière afin de générer un motif complexe, l’imagerie basée sur l’interférence du motif permet d’obtenir des niveaux de détail super-résolution,résolvant des objets aussi petits que 200 nm. Plus d’informations sur la SIM peuvent être lues sur l’appnote SIM sur notre site Web.
Summary
L’imagerie à large champ est la base de la plupart des études cellulaires, permettant aux chercheurs d’imager rapidement et facilement des échantillons avec de faibles niveaux de préparation d’échantillons ou d’expertise technique nécessaire. Du fond clair à l’imagerie de fluorescence, le champ large est une technique puissante et variée avec laquelle de nombreux chercheurs sont familiers. Bien que la technique puisse manquer de résolution par rapport à la microscopie confocale ou à d’autres applications de microscopie avancées, l’imagerie grand champ a une place solide dans la recherche et continuera à se développer au fil du temps.