Modification de la méthode de Winkler pour la détermination de la concentration en oxygène dissous dans de petits volumes d’échantillons
Première publication le 27 août 2010
La méthode de Winkler est la procédure la plus populaire pour déterminer la concentration en oxygène dissous (OD) dans les échantillons d’eau. Cependant, cette méthode nécessite un volume d’échantillon relativement important de 200 ml pour une détermination précise de l’OD. De nombreuses méthodes alternatives ont été proposées pour mesurer les concentrations d’OD dans de petits volumes d’échantillons, mais la plupart de ces méthodes présentent des problèmes de faible précision, de coût élevé, d’instrumentation compliquée ou de temps d’analyse long. Dans cet article, une modification simple de la méthode de Winkler est proposée pour mesurer les concentrations d’OD dans des échantillons d’un volume de 1 ml. La méthode proposée est précise, peu coûteuse, simple et rapide. Les concentrations d’OD ont été mesurées dans 33 échantillons à la fois par la méthode conventionnelle de Winkler (WM) et par la méthode proposée (PM). Pour 23 des 33 échantillons analysés, l’hypothèse selon laquelle les moyennes de population des mesures sont égales (μ1 = μ2) n’a pu être rejetée à un niveau de confiance de 95 % et pour 19 échantillons, l’hypothèse selon laquelle les variances de population des mesures sont égales (σ21 = σ22)n’a pu être rejetée à un intervalle de confiance de 95 %. Il a donc été conclu que, dans la plupart des cas, les mesures de l’OD par WM et PM donnent des résultats comparables tant en termes d’exactitude que de précision.
Introduction
La méthode de Winkler (méthode n° 4500-O-C)1 a été universellement acceptée comme une méthode précise et fiable2 pour la mesure de la concentration en oxygène dissous (OD) dans une variété d’échantillons d’eau. Cette méthode est considérée comme la référence pour la détermination de l’OD. Cependant, le principal inconvénient de cette méthode est la nécessité d’un grand volume d’échantillon de 200 ml.3
De nombreuses méthodes alternatives ont également été développées pour mesurer l’OD. Ces méthodes se répartissent en trois catégories distinctes, (1) les méthodes colorimétriques, (2) les méthodes utilisant la chromatographie en phase gazeuse et (3) les méthodes utilisant des capteurs électrochimiques et optiques. Les méthodes colorimétriques peuvent être utilisées pour déterminer l’OD dans de petits volumes d’échantillons. Cependant, elles présentent des inconvénients tels que la nécessité d’utiliser des réactifs chimiques coûteux (par exemple, un sol d’or) ou toxiques (par exemple, du cyanure).4 L’absence de justification appropriée dans le choix de la longueur d’onde de mesure est un autre facteur limitant pour ces méthodes.5 La détermination de l’OD est également possible en utilisant la chromatographie en phase gazeuse. Cependant, les méthodes de chromatographie en phase gazeuse, bien que précises et nécessitant de petits volumes d’échantillons, sont néanmoins longues et coûteuses. Les capteurs électrochimiques ont été largement utilisés pour mesurer l’OD et leurs avantages et inconvénients ont été examinés ailleurs.6 Les capteurs électrochimiques souffrent généralement d’effets de pression irréversibles, de contamination par le sulfure d’hydrogène et de sensibilité croisée.7 Ils consomment également de l’OD pendant la mesure et peuvent donc être inadaptés aux très petits volumes d’échantillons. L’accent a été mis récemment sur le développement de capteurs optiques basés sur le principe de l’extinction dynamique de la luminescence de l’oxygène.8 Ces capteurs optiques sont faciles à utiliser, ont un temps de réponse rapide et sont durables. Cependant, tous les capteurs, qu’ils soient électrochimiques ou optiques, nécessitent un étalonnage par rapport à la méthode de Winkler en raison de la sensibilité des capteurs à la température et à la pression.9,10 Ils sont également sensibles au bio-fouling et à la croissance bactérienne sur la surface du capteur.8
En raison des limitations inhérentes aux méthodes alternatives telles que décrites ci-dessus et de leur dépendance à la méthode de Winkler pour la vérification croisée et l’étalonnage, plusieurs modifications de la méthode de Winkler elle-même ont également été proposées pour mesurer les concentrations d’OD dans des volumes d’échantillons de 1 à 10 ml.11,12,13 Cependant, ces méthodes de » Micro-Winkler » ne sont pas très populaires en raison des exigences instrumentales complexes et des précautions élaborées nécessaires pour éviter la contamination des échantillons par des échanges avec l’oxygène atmosphérique. Ces méthodes ont fait l’objet d’un examen critique dans d’autres publications.14 Une méthode gravimétrique de titrage Micro-Winkler a récemment été proposée15 pour la mesure de l’OD dans de petits échantillons. Cependant, cette procédure nécessite des mesures gravimétriques multiples et précises à l’aide d’une balance sensible et semble donc assez complexe.
Sur la base de l’examen de la littérature, il apparaît que presque toutes les méthodes développées pour les mesures de l’OD dans les petits échantillons sont déficientes d’une manière ou d’une autre. D’où la nécessité permanente de développer une meilleure méthode, c’est-à-dire exacte, précise, peu coûteuse, simple et rapide pour la mesure de l’OD dans de petits volumes d’échantillons.
Outline of the proposed method
Le principal défi de la mesure des concentrations d’OD dans de petits échantillons est la prévention de la contamination des échantillons par interaction avec l’atmosphère. Il est proposé d’introduire une couche liquide isolante entre l’échantillon d’eau et l’atmosphère. Les propriétés requises du liquide isolant sont : l’immiscibilité dans l’eau, une densité inférieure à celle de l’eau et une capacité de dissolution de l’oxygène négligeable. Il est proposé que le liquide isolant soit pris dans une fiole et que l’échantillon d’eau dont l’OD doit être déterminée (volume de 1 mL) soit directement introduit sous la couche de liquide isolant. Cette étape permet d’isoler efficacement l’échantillon d’eau de l’atmosphère. L’OD dans l’échantillon d’eau peut ensuite être fixé et converti en une quantité équivalente d’iode en utilisant les mêmes réactifs que ceux utilisés dans la méthode de Winkler. La solution d’iode est ensuite extraite du flacon à l’aide d’une seringue et titrée à l’aide de Na2S2O3 pour déterminer la concentration en DO dans l’échantillon.
Après plusieurs séries d’essais, le n-hexane a été choisi comme liquide isolant comme décrit ci-dessus. Le n-hexane est plus léger que l’eau (gravité spécifique = 0,7) et est pratiquement immiscible dans l’eau. La solubilité de l’oxygène dans le n-hexane est de 0,002 fraction molaire16, c’est-à-dire que l’oxygène est pratiquement insoluble dans le n-hexane.
Matériel et méthodes
Tous les réactifs utilisés étaient de qualité réactif analytique (>99% de pureté, Loba Chemicals, Inde). De l’eau dé-ionisée (Milli-Q, Millipore, USA) a été utilisée pour la préparation des réactifs et la dilution des échantillons. Le n-hexane utilisé était de qualité HPLC (pureté >99%, Merck, Inde). La verrerie en borosilicate a été utilisée dans cette étude. Les solutions de MnSO4 et d’alcali-azide-iodure ont été préparées selon les méthodes standard (méthode n° 4500-O C).1
La procédure de mesure de l’OD par la méthode proposée (PM) était la suivante. Initialement, 0,5 mL de n-hexane a été transféré dans un flacon en verre de 16 mL (Wheaton Science, USA). Ensuite, 1 mL de n-hexane a été prélevé dans une pipette de 2 mL, puis la pipette a été remplie de 1 mL de l’échantillon d’eau dont la concentration en OD devait être déterminée. La procédure de collecte d’échantillons ci-dessus a permis de s’assurer que l’échantillon était collecté sans espace de tête. Cette étape de collecte de l’échantillon est la plus cruciale, car l’apparition de toute bulle ou espace d’air dans l’interface hexane-eau ou ailleurs dans la pipette peut entraîner des erreurs. L’embouchure de la pipette a ensuite été placée sous la couche d’hexane dans le flacon et l’échantillon a ainsi été introduit sous la couche d’hexane, évitant tout contact entre l’échantillon et l’atmosphère. Le prélèvement de l’échantillon dans la pipette et l’application de l’échantillon sous la couche d’hexane dans le flacon doivent être effectués le plus rapidement possible afin de minimiser les erreurs. Ensuite, 5 μL de MnSO4 ont été introduits dans l’échantillon d’eau sous la couche d’hexane à l’aide d’une micro-seringue de 10 μL (Hamilton, USA), suivis d’un ajout similaire de 5 μL de solution d’alcali-azide-iodure. La formation du précipité a commencé immédiatement après les additions et était complète en 3 min. Ensuite, 0,1 mL de H2SO4 conc. a été ajouté à l’aide d’une micro-pipette au précipité formé sous la couche d’hexane. Le précipité a été dissous en 3 min et une solution d’iode jaune s’est formée sous la couche d’hexane. Exactement 1 mL de la solution d’iode a été extrait de la couche d’hexane à l’aide d’une micro-seringue et transféré dans un bécher de 25 mL. La solution d’iode de 1 mL dans le bécher a été diluée à ∼10 mL en ajoutant de l’eau dé-ionisée pour faciliter le titrage. L’ajout d’eau désionisée ne fait que diluer la solution d’iode, sans affecter la quantité d’iode dans le bécher. Le contenu du bécher a été titré avec une solution de Na2S2O3 0.00625 M. 1 mL de ce titrant correspond à 55,5 mg L-1 d’OD dans l’échantillon original. Le titrant a été pris dans une micro-seringue de 250 μL (Hamilton, USA) et ajouté goutte à goutte dans le bécher sous agitation constante jusqu’à ce que la couleur jaune de l’iode soit presque déchargée. Ensuite, 1 à 2 gouttes de solution d’amidon ont été ajoutées et le titrage a continué jusqu’à ce que la couleur bleue due à l’amidon soit déchargée. Sur la base du volume de titrant requis dans un titrage particulier, la concentration de DO dans l’échantillon original a été calculée.
La concentration de DO a également été déterminée dans divers échantillons en utilisant la méthode de Winkler (WM). Les exigences en matière de réactifs et d’autres détails des deux méthodes sont présentés dans le tableau 1.
| N° d’échantillon. | Réactif | Quantités | Résistance | ||
|---|---|---|---|---|---|
| WM | PM | WM | PM | ||
| Echantillon | 200 mL | 1 mL | – | – | |
| MnSO4 | 1 mL | 5 μL | Selon WM | ||
| Alkali-azide-iodure réactif | 1 mL | 5 μL | Comme par WM | ||
| Na2S2O3 | Comme requis | Comme requis | 0.025M | 0,00625M | |
| H2SO4 | 1 mL | 0.1 mL | Selon WM | ||
| Amidon | 1-2 gouttes | 1-2 gouttes | Selon WM | ||
| n-Hexane | Non utilisé | 1.5 mL | – | – | |
Résultats et discussion
La concentration d’OD a été mesurée dans 33 échantillons d’eau (voir tableau 2) obtenus à divers endroits dans et autour de la ville de Kanpur, en Inde. Parmi les 33 échantillons, 8 étaient des échantillons d’eau du robinet, 16 étaient des échantillons d’eau de rivière, 6 étaient des échantillons d’eaux usées domestiques diluées avec l’eau du robinet, 2 étaient des échantillons d’eau souterraine et 1 était un échantillon d’eau d’étang. Les échantillons ont été choisis de manière à ce que les concentrations d’OD puissent être mesurées dans une grande variété de matrices d’échantillons. Pour chaque échantillon, plusieurs mesures répétées de l’OD ont été effectuées, à la fois par WM et par le PM. Les moyennes d’échantillon calculées (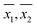 ), les écarts types d’échantillon (S1, S2) et le nombre de mesures répétées (n1, n2) pour WM et PM respectivement sont présentés dans le tableau 2 pour chaque échantillon.
), les écarts types d’échantillon (S1, S2) et le nombre de mesures répétées (n1, n2) pour WM et PM respectivement sont présentés dans le tableau 2 pour chaque échantillon.
Les tracés normaux des ensembles de mesures répétées par les deux méthodes étaient tous approximativement linéaires, ce qui indique que les mesures répétées étaient normalement distribuées et pouvaient donc faire l’objet d’une analyse statistique supplémentaire sur cette base. À titre d’illustration, les tracés normaux de cinq mesures d’échantillons effectuées par la MW sont présentés sur la figure 1A. Les tracés normaux pour les mêmes mesures de cinq échantillons effectuées par la PM sont présentés à la figure 1B.
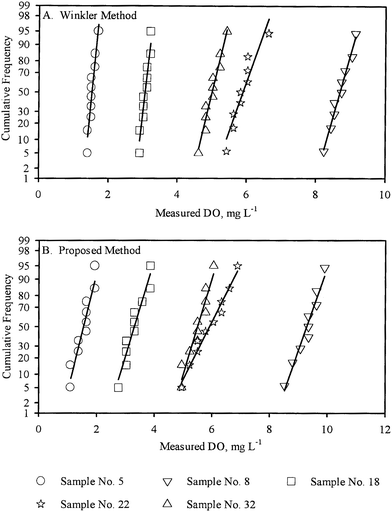
Les variances (S21,S22) dans les mesures répétées d’un échantillon par WM et PM respectivement ont été utilisées pour une comparaison par paire des variances de population correspondantes (σ21,σ22) en utilisant le test F. Sur les 33 échantillons pour lesquels l’OD a été mesurée par les deux méthodes (WM et PM), l’hypothèse selon laquelle les variances de population étaient égales (σ21 = σ22) n’a pas pu être rejetée à un niveau de confiance de 95 % pour 19 échantillons. En outre, l’hypothèse, σ21 > σ22 n’a pas pu être rejetée pour 4 échantillons, tandis que l’hypothèse, σ21 < σ22 n’a pas pu être rejetée pour les 10 échantillons restants, tous au niveau de confiance de 95 pour cent. Ces résultats ont été résumés dans le tableau 3.
En outre, les variances d’échantillon (S21,S22) et les moyennes d’échantillon (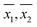 ) pour chaque échantillon, telles qu’obtenues par WM et PM respectivement ont été utilisées pour la comparaison par paire des moyennes de population correspondantes (μ1, μ2). Pour les échantillons à variances égales (voir tableau 3), la comparaison par paires a été effectuée à l’aide du test t de Student. Pour les échantillons à variances inégales (voir tableau 3), la comparaison par paire a été effectuée à l’aide du test t de variance inégale.17 Dans 23 des 33 échantillons où les mesures de l’OD ont été effectuées à la fois par WM et PM, l’hypothèse selon laquelle les moyennes de population étaient égales (μ1 = μ2) n’a pas pu être rejetée à un niveau de confiance de 95 %.
) pour chaque échantillon, telles qu’obtenues par WM et PM respectivement ont été utilisées pour la comparaison par paire des moyennes de population correspondantes (μ1, μ2). Pour les échantillons à variances égales (voir tableau 3), la comparaison par paires a été effectuée à l’aide du test t de Student. Pour les échantillons à variances inégales (voir tableau 3), la comparaison par paire a été effectuée à l’aide du test t de variance inégale.17 Dans 23 des 33 échantillons où les mesures de l’OD ont été effectuées à la fois par WM et PM, l’hypothèse selon laquelle les moyennes de population étaient égales (μ1 = μ2) n’a pas pu être rejetée à un niveau de confiance de 95 %.
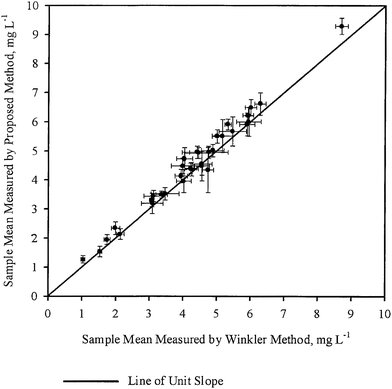
Les moyennes d’échantillon (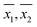 ) pour chaque échantillon, telles qu’obtenues par WM et PM respectivement ont été tracées les unes par rapport aux autres dans la figure 2. Les barres d’erreur indiquées dans la figure correspondent aux intervalles de confiance à 95 % correspondants. Une ligne de pente unitaire passant par l’origine a également été tracée sur la même figure. On a observé que tous les points étaient très proches de la ligne de pente unitaire, ce qui est en accord avec les conclusions générales tirées dans le tableau 3, c’est-à-dire que pour la plupart des échantillons, la concentration moyenne d’OD obtenue par les deux méthodes n’est pas statistiquement différente. Ainsi, dans la plupart des cas, la mesure de l’OD par PM était aussi précise que la mesure de l’OD par WM.
) pour chaque échantillon, telles qu’obtenues par WM et PM respectivement ont été tracées les unes par rapport aux autres dans la figure 2. Les barres d’erreur indiquées dans la figure correspondent aux intervalles de confiance à 95 % correspondants. Une ligne de pente unitaire passant par l’origine a également été tracée sur la même figure. On a observé que tous les points étaient très proches de la ligne de pente unitaire, ce qui est en accord avec les conclusions générales tirées dans le tableau 3, c’est-à-dire que pour la plupart des échantillons, la concentration moyenne d’OD obtenue par les deux méthodes n’est pas statistiquement différente. Ainsi, dans la plupart des cas, la mesure de l’OD par PM était aussi précise que la mesure de l’OD par WM.
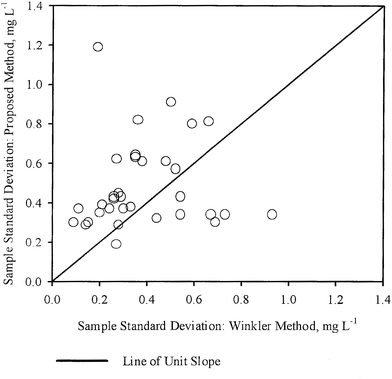
Les écarts types des échantillons (S1,S2) pour chaque échantillon, tels qu’obtenus par WM et PM respectivement ont été tracés les uns par rapport aux autres dans la figure 3. Une ligne de pente unitaire passant par l’origine a également été tracée sur la même figure. Dans ce cas, les points semblent être dispersés assez uniformément par rapport à la ligne de pente unitaire, certains points étant proches de la ligne, tandis que les autres en sont plus éloignés. Ces observations sont également en accord général avec les conclusions tirées du tableau 3, c’est-à-dire que pour la plupart des échantillons, la variation de la concentration d’OD mesurée par les deux méthodes n’est pas statistiquement différente. Ainsi, dans la plupart des cas, la mesure de l’OD par PM était aussi précise que la mesure de l’OD par WM.
Il a été conclu qu’avec une manipulation et un titrage soigneux des échantillons, la méthode proposée (PM) peut produire des résultats comparables à la méthode de Winkler (WM) à la fois en termes d’exactitude et de précision. Néanmoins, la précision de la détermination de l’OD par la PM peut probablement être augmentée en utilisant une micro-seringue avec un nombre inférieur pour le titrage final. La micro-seringue utilisée dans cette étude avait un comptage minimal de 5 μL, ce qui correspond à une incertitude de ∼0,25 mg L-1 DO dans les conditions de la présente étude. Cette incertitude peut être abaissée en utilisant une micro-seringue dont le compte le plus faible.
Conclusions
L’objectif de cette étude était de développer une méthode précise, peu coûteuse, simple et rapide pour mesurer l’OD dans de petits volumes d’échantillons. Sur la base des résultats et de l’analyse présentés, on peut conclure que la méthode proposée répond à la plupart des problèmes susmentionnés. Les principales conclusions de l’étude sont les suivantes :
➢ L’introduction d’une couche isolante de n-hexane pour prévenir le transfert d’oxygène entre l’échantillon aqueux et l’atmosphère permet d’obtenir une détermination cohérente et précise de l’OD dans de petits volumes d’échantillons. Il s’agit de la principale innovation incorporée dans la méthode proposée.
➢ Il a également été démontré qu’en prenant des précautions adéquates, la méthode proposée (PM) peut généralement produire des résultats statistiquement comparables aux résultats obtenus par la méthode de Winkler (WM), à la fois en ce qui concerne la concentration moyenne en DO et également en ce qui concerne la variance de la concentration en DO autour de la moyenne.
➢ Les exigences en matière de réactifs et de verrerie pour la méthode proposée sont moindres que celles de la méthode de Winkler, principalement en raison du plus petit volume d’échantillon utilisé. Le n-hexane est le seul réactif supplémentaire utilisé, mais la petite quantité (∼1,5 mL par échantillon) de n-hexane nécessaire a un impact négligeable sur le coût global de l’analyse des échantillons.
Donc, la méthode proposée (PM) peut être utilisée pour les mesures de l’OD dans toutes les circonstances où la méthode de Winkler est actuellement utilisée. La méthode proposée est particulièrement utile dans les circonstances où la méthode de Winkler ne peut pas être utilisée en raison des limitations du volume d’échantillon disponible.