Lavage bilatéral du poumon entier dans la protéinose alvéolaire pulmonaire – Une étude rétrospective
Introduction
La protéinose alvéolaire pulmonaire (PAP) est une maladie pulmonaire diffuse rare avec trois formes cliniques, congénitale, acquise (idiopathique) et secondaire, caractérisée par une accumulation de grandes quantités d’une matière phospholipoprotéique dans les alvéoles due à une déficience de l’activité du facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF)1-14 (Fig. 1). Ce phénomène est associé à une fonction anormale des macrophages et à une altération de la clairance du surfactant dans les poumons. La PAP a une prévalence de 3,7 cas par million, une prépondérance masculine (rapport homme/femme de 4:1) et 80 % des cas sont signalés au cours de la troisième et de la quatrième décennie de vie6
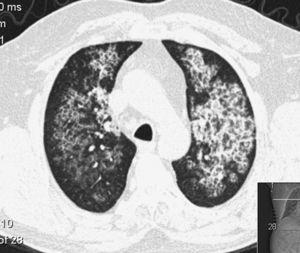
TDM d’un patient atteint de protéinose alvéolaire pulmonaire. Notez les septa interlobaires épaissis dans le parenchyme opacifié produisant un motif de « pavage fou ».
Lavage du poumon entier (LPA), introduit dans les années 1960,3,4,7,10,15 est toujours le traitement de référence6. Le WLL unilatéral, avec le lavage effectué dans chaque poumon en différentes sessions séparées par des jours/semaines, est la procédure la plus fréquente. Cependant, le WLL séquentiel bilatéral dans la même session de traitement est une alternative intéressante, car il prend beaucoup moins de temps, avec une réduction de l’inconfort du patient et est plus rentable.
Son efficacité a été attribuée non seulement à l’élimination du matériel lipoprotéinique des espaces alvéolaires, mais aussi à l’élimination des anticorps anti-GM-CSF, des macrophages alvéolaires et des cellules épithéliales de type II. Cette procédure thérapeutique est envisagée lorsqu’une limitation significative des activités quotidiennes est rapportée par le patient et/ou une hypoxémie avec une pO2
60mmHg, une P(A-a) O2 ≥40mmHg et une fraction de shunt ≥10% est détectée12.
Dans notre Hôpital, nous avons réalisé le premier WWL en 2010 et après cinq WLL unilatéraux, nous sommes passés à un programme de WWL bilatéral séquentiel.
Le but de ce rapport est de décrire la technique de WLL bilatéral et de discuter de sa sécurité et de son efficacité.
Méthodes
Dans cette étude rétrospective, nous avons recueilli des données démographiques et cliniques à partir des rapports médicaux de trois patients adultes. La technique standard appliquée était une version modifiée du protocole technique du Royal Brompton Hospital (Londres).6,10
Pendant toute la procédure, l’électrocardiographie, l’oxymétrie de pouls (SatO2), la pression artérielle invasive, la pression veineuse centrale (PVC), le débit urinaire, la capnographie, les volumes courants, l’indice bispectral (BIS) et la température centrale ont été surveillés en permanence et les gaz du sang artériel (GSA) ont été effectués toutes les heures. Une anesthésie intraveineuse totale (AIVT) a été réalisée pour permettre de gérer la profondeur de l’anesthésie, indépendamment des variations ventilatoires inhérentes à la procédure. La curarisation a été maintenue tout au long de la procédure. Un tube à double lumière (DLT) gauche a été introduit, en choisissant la plus grande taille possible, afin d’assurer l’isolation des poumons et de favoriser la ventilation et l’efficacité du WLL. Sa position correcte a été confirmée par bronchoscopie à fibre optique et la pression d’insufflation du brassard mesurée afin d’éviter toute fuite controlatérale du liquide de lavage.11
Une pré-oxygénation avec une FiO2 de 100% a été réalisée pendant 5min pour assurer une dénitrogénation alvéolaire correcte et l’apparition de bulles d’air, qui pourraient nuire à l’élimination du matériel lipoprotéinique des alvéoles. La ventilation à un seul poumon a été mise en route et l’isolement pulmonaire vérifié. Les patients ont été ventilés par ventilation à pression contrôlée, avec une valeur de pression inférieure à 30cmH2O. Le volume de solution saline à instiller a été calculé par les mesures préopératoires de la capacité résiduelle fonctionnelle (CRF). Le volume du poumon droit a été calculé par 3/5 de la CRF et le poumon gauche par 2/5 de la CRF (dans le premier cycle, un plus petit volume a été instillé). Le sérum physiologique doit être instillé sous l’effet de la gravité à une hauteur ne dépassant pas 40 cm au-dessus de la ligne médio-axillaire, afin d’éviter un barotraumatisme et une fuite vers le poumon ventilé10. Bien que certains rapports décrivent un positionnement en décubitus latéral à 30° afin de préserver le rapport ventilation/perfusion du poumon ventilé dépendant, cela augmente la probabilité d’inondation du poumon controlatéral, nous avons donc préféré un positionnement en décubitus dorsal, avec un trendelenburg inversé ainsi qu’un positionnement en trendelenburg pour faciliter l’instillation gravitationnelle et le retrait du sérum physiologique chaud des poumons6,11. Ce positionnement a été adopté lorsqu’un WLL bilatéral a été effectué (figure 2).
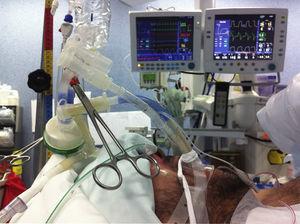
Représentation technique d’une WLL.
Lorsque l’écoulement, initialement laiteux, devient moins dense, le drainage est interrompu à la moitié du volume, et plusieurs cycles de ventilation manuelle à l’aide d’une valve CPAP avec une limite de pression de 5-10mmHg (la « modification de Bingisser ») permettent une percussion manuelle des alvéoles. Cette manœuvre améliore grandement la clairance lipoprotéinique.12,14 Le cycle de lavage a été répété jusqu’à ce que l’écoulement de lavage devienne limpide (Fig. 3). Le volume de lavage étant élevé pendant l’intervention, le risque d’hypothermie est élevé. La conservation de la température corporelle est cruciale et doit être maintenue en utilisant un liquide de lavage chauffé à 37°C et une couverture chauffante.

Évolution du liquide laiteux au cours de la procédure.
Après que le premier poumon ait été lavé avec succès, il a été soigneusement aspiré et sa réexpansion a été effectuée, d’abord par une ventilation bilatérale suivie d’une ventilation unilatérale. Après 1h de ventilation, les données de compliance pulmonaire et d’analyse des gaz du sang ont été vérifiées. Si le poumon lavé pouvait assurer les besoins en échange gazeux du patient, alors le WLL controlatéral était initié, en répétant les procédures décrites ci-dessus.8
À la fin de la procédure, la solution saline résiduelle était aspirée par bronchoscopie à fibre optique et la ventilation bilatérale était reprise. Le tube à double lumière a ensuite été remplacé par un tube endotrachéal et le patient a été transféré dans une unité de récupération pour une surveillance de nuit.
Résultats
Une WWL bilatérale a été réalisée chez trois patients adultes, 2 hommes et 1 femme, d’âge moyen 43,6 (fourchette 39 – 47 ans) (tableau 1), tous présentant une hypoxie au repos inférieure à 60mmHg.
Quantité de solution saline instillée et retenue dans le WWL bilatéral.
| Lavages | Volume (L) Poumon droit | Volume (L) Poumon gauche | ||
| Volume (L) instillé volume (L) | Solde positif (mL) | Volume instillé (L) | Solde positif (mL) | |
| 1ère | 9.2 | 470 | 11,8 | 510 |
| 2ème | 15,3 | 530 | 10,7 | 450 |
| 3ème | 14.0 | 600 | 10.8 | 550 |
| 4ème | 13.5 | 500 | 10.6 | 350 |
| 5ème | 15.5 | 930 | 11.1 | 480 |
| 6ème | 15.5 | 820 | 15.3 | 900 |
Le premier patient était un homme, 39 ans, fumeur, boulanger, diagnostiqué avec une PAP un mois avant la première WLL, sur la base des caractéristiques cliniques, radiologiques et du LBA et de la présence d’anticorps sériques GM-CSF. Lors de la présentation de la maladie, il présentait une insuffisance respiratoire associée à une atteinte pulmonaire bilatérale étendue observée au HRCT-scan et une WLL bilatérale a été réalisée avec 9,2 et 11,8 litres de solution saline instillés dans le poumon droit et gauche respectivement. Après une courte période d’amélioration clinique, fonctionnelle et radiologique, l’état du patient s’est aggravé avec l’extension des opacités pulmonaires radiologiques et l’insuffisance respiratoire. Cette détérioration clinique a coïncidé avec son retour au travail. En effet, la farine de boulangerie avait été décrite comme un déclencheur potentiel.16 Un second WLL bilatéral a été réalisé trois mois plus tard, et 15,3 et 10,7L de solution saline ont alors été instillés. Après cette procédure et l’arrêt de son environnement de travail antérieur, le patient a maintenu une stabilité clinique.
Le deuxième patient soumis à une WLL était une femme, âgée de 47 ans, agricultrice, non fumeuse, sans comorbidités, avec le diagnostic de PAP un mois avant la première WLL sur la base des caractéristiques cliniques, radiologiques et du LBA et la présence d’anticorps sériques GM-CSF. La présentation clinique était très similaire à celle du premier patient, avec une dyspnée à l’effort et une toux sèche associée à une insuffisance respiratoire et de larges opacités bilatérales en pavé fou au scanner HRCT. Après le diagnostic, un WLL a été réalisé avec instillation de 14 et 10,8L de solution saline dans le poumon droit et gauche respectivement. Après une brève amélioration clinique initiale, elle a été soumise à un autre WLL 1,5 mois plus tard, car elle était devenue plus symptomatique et avec une paO2
60mmHg. Avec cette procédure, un total de 13,5 et 10,6L ont été instillés dans le poumon droit et gauche respectivement. Quatre mois plus tard, une troisième WLL a été réalisée en raison d’une détérioration clinique et, à cette occasion, 15,5 et 11,1 litres ont été instillés dans le poumon droit et gauche respectivement (Fig. 4). Après cette procédure, le patient a atteint une stabilité clinique, fonctionnelle et radiologique.

Echantillons séquentiels de WLL bilatéraux.
Le troisième patient inclus était un homme, 45 ans, ex-fumeur, ouvrier dans une usine de pneumatiques, avec le diagnostic de PAP lors d’une évaluation et d’un traitement d’un abcès cérébral induit par une nocardia. Comme pour les deux autres patients, le diagnostic a été établi par des caractéristiques radiologiques et LBA typiques associées à des anticorps sériques GM-CSF. Cependant, il avait déjà subi une HRCT thoracique avec un motif de pavage fou bilatéral deux ans auparavant. Un an après le diagnostic, il est devenu plus symptomatique, avec une dyspnée à l’effort et une insuffisance respiratoire (paO2-57mmHg) et a donc été soumis à un LBA avec instillation de 15,5 et 15,3 de solution saline dans le poumon droit et gauche respectivement. Après cette procédure, il a obtenu une amélioration clinique, fonctionnelle et radiologique significative.
Les six procédures de WLL ont été effectuées selon le protocole établi et sans aucune complication majeure.
Le suivi gazométrique horaire s’est concentré sur l’assurance d’une oxygénation et d’une ventilation correctes. Les valeurs gazométriques du patient ont été facilement maintenues tout au long de la procédure, avec une pCO2 inférieure à 55mmHg et une SpO2 soutenue au-dessus des valeurs propres du patient actuel bien qu’il soit en position couchée (tableau 2) (Fig. 5). En effet, chez tous les patients soumis à une WWL bilatérale, nous avons observé une installation progressive de l’acidose métabolique pendant la procédure. Cette acidose métabolique a été inversée dans les premières heures postopératoires et aucune comorbidité n’a été identifiée par la suite.
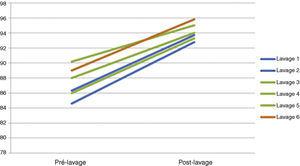
Évolution des mesures de SatO2 pendant les lavages de poumons entiers.
Avec la manœuvre de Bingisser, nous avons observé une difficulté transitoire à récupérer le volume de lavage (contribuant à un bilan hydrique positif) mais une augmentation évidente de la densité du lavage.
Dans tous les cas, nous avons observé un épisode d’extravasation du lavage controlatéral. Dans toutes les procédures, la température corporelle a été maintenue entre 36 et 37°C. La durée moyenne de la procédure était de 8h (intervalle 7h32-9h41).
Le temps d’extubation variait en fonction de l’évolution clinique et de l’analyse des gaz du sang et tous les patients ont été extubés avec succès après 18h.
Après ces procédures, la capacité fonctionnelle et les activités quotidiennes de tous les patients ont été significativement améliorées, documentées par les signes/symptômes cliniques ainsi que par les épreuves fonctionnelles respiratoires et les données gazométriques.
Discussion
Dans cette courte communication, nous avons décrit six procédures de WLL séquentielles bilatérales, réalisées chez trois patients atteints de PAP, corroborant son efficacité et sa sécurité cliniques.
Malgré son invasivité significative, la WLL reste le traitement recommandé dans la PAP, et a été jusqu’à présent la seule thérapeutique à l’efficacité établie. En fait, lorsqu’un patient atteint de PAP présente une insuffisance respiratoire et des opacités étendues à l’HRCT, cette procédure est obligatoire. La WLL est une technique coûteuse et longue, qui exige l’expertise d’une approche multidisciplinaire, ce qui, avec la rareté de la PAP, explique pourquoi cette procédure n’est réalisée que dans un petit nombre de centres. Le choix d’une WLL bilatérale signifie un meilleur confort pour le patient, une réduction des coûts et du temps et le maintien de l’efficacité clinique.
Les trois patients inclus pourraient être considérés comme des cas typiques de PAP, bien qu’il y ait quelques différences. Deux d’entre eux avaient une présentation aiguë de la maladie, nécessitant une WLL après le diagnostic, tandis que le troisième a été soumis à cette procédure au cours de la maladie. Alors que ce troisième patient n’a dû être soumis qu’à un seul WLL, les deux autres ont dû subir plusieurs WLL, pour être précis à deux et trois procédures.
Le facteur crucial pour pouvoir procéder au deuxième lavage pulmonaire est de savoir si la ventilation du premier lavage pulmonaire a récupéré une capacité suffisante pour assurer les besoins du patient. Pour cette raison, s’il n’y a pas de prédominance latérale, nous choisissons le plus gros poumon, le poumon droit, pour être lavé en premier. Pour prévenir le barotraumatisme, la pression inspiratoire maximale était limitée à 30cmH2O. Dans toutes les procédures, après 1h de ventilation, la compliance pulmonaire et les valeurs gazométriques en ventilation monopulmonaire du poumon lavé étaient compatibles avec le début du lavage du second poumon.
Le choix d’une ventilation à pression contrôlée nous a permis de surveiller en permanence les changements de compliance pulmonaire pendant le lavage et a évité une éventuelle dislocation du tube ou toute autre interférence. De plus, de la même manière, il a permis d’observer la récupération de la compliance pulmonaire lavée.
La position couchée du patient n’a pas gêné l’oxygénation, et nous n’avons donc pas eu à recourir à la position de décubitus latéral avec ventilation du poumon dépendant, positionnement moins stable et comportant plus de risques dans une procédure longue (8h en moyenne).
Nous avons choisi la percussion de la manœuvre de Bingisser en raison du fait que la pression exercée sur les voies respiratoires est mesurée, contrairement aux manœuvres de kinésithérapie, où cette quantification est impossible, réduisant ainsi le risque d’une pression de percussion excessive, évitant et prévenant une éventuelle inondation controlatérale8.
Pour tenter d’inverser l’acidose métabolique observée pendant les procédures, le sérum d’entretien utilisé pendant la période périopératoire – chlorure de sodium à 0,9 % – a été remplacé par du lactate de Ringer lors de la troisième procédure bilatérale et par la suite, avec seulement des améliorations modestes. Dans la littérature, il n’y a aucune référence à l’utilisation de ce soluté comme liquide de lavage pour le poumon, le chlorure de sodium reste donc utilisé.
En conclusion, compte tenu de l’efficacité clinique du WLL bilatéral, ses avantages en termes de gain de temps et de coûts et de réduction de l’inconfort du patient font de cette technique un premier choix approprié pour le lavage thérapeutique chez les patients PAP.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent que les procédures suivies étaient conformes aux règlements du comité d’éthique de la recherche clinique concerné et à ceux du Code d’éthique de l’Association médicale mondiale (Déclaration d’Helsinki).
Confidentialité des données
Les auteurs déclarent avoir suivi les protocoles de leur centre de travail sur la publication des données des patients.
Droit à la vie privée et consentement éclairé
Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.