Actualités
20 juillet, 2015
Les découvertes fournissent une nouvelle cible potentielle pour interférer avec le cycle de vie viral
Par Jocelyn Duffy / 412-268-9982 / [email protected]
Tous les virus ont des enveloppes de force industrielle qui entourent et protègent le matériel génétique à l’intérieur, permettant aux particules virales de rester stables, infectieuses et capables de se propager. Alex Evilevitch, biophysicien à l’Université Carnegie Mellon, et ses collègues ont maintenant identifié le talon d’Achille de cette coque résistante.
Publiés dans le Journal of Virology, la revue de référence dans le domaine, les résultats mettent en évidence la partie la plus faible de la coque virale et fournissent une nouvelle cible potentielle pour interférer avec le cycle de vie viral et pour développer des véhicules stables d’administration de thérapie génique.
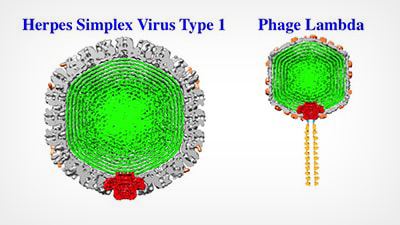
Les virus comme l’Herpès Simplex 1 et le Phage Lambda ont des enveloppes externes résistantes (en gris) qui enferment et protègent l’ADN viral (en vert). Alex Evilevitch et ses collègues ont maintenant identifié le talon d’Achille de cette coque résistante, le portail viral (rouge). Les images ci-dessus sont des reconstructions Cryo EM ; le schéma du portail est superposé.
L’enveloppe extérieure, appelée capside, enferme le matériel génétique d’un virus. Des virus comme le virus Herpes Simplex de type 1 (HSV-1) contiennent de l’ADN double brin, dont les longs brins sont serrés et exercent une pression énorme, atteignant des dizaines d’atmosphères, sur la paroi intérieure de la capside. Dans des travaux précédents, Evilevitch a mesuré pour la première fois cette pression dans le HSV-1 ; il a également montré que c’est cette pression qui propulse l’ADN hors d’un petit portail dans la capside du virus et dans une cellule hôte.
Avec ses dernières recherches, Evilevitch et David Bauer, étudiant diplômé en physique, révèlent que le portail est plus qu’un simple conduit pour l’ADN. Il s’agit également de la partie structurelle la plus faible de la capside.
« La chose la plus excitante ici est que nous avons montré, pour la première fois, comment la pression de l’ADN affecte la stabilité de la porte, qui détermine finalement la stabilité du virus dans le temps à n’importe quelle température », a déclaré Evilevitch, professeur associé de physique et membre du Centre de la CMU pour la mécanique et l’ingénierie des systèmes cellulaires.
La porte est un composant critique des capsides virales. Composé de plusieurs protéines différentes, le complexe portal emballe activement l’ADN pendant l’assemblage viral, libère l’ADN pendant l’infection et, comme le révèle la nouvelle recherche, est essentiel pour maintenir l’équilibre délicat de la capside, qui est suffisamment stable pour retenir le génome tout en étant suffisamment instable pour permettre une libération efficace du génome pendant l’infection.
« Des expériences précédentes ont étudié le rôle de la pression interne sur l’intégrité structurelle des capsides virales », a déclaré Evilevitch. « Ici, nous fournissons la première preuve expérimentale que c’est la résistance mécanique du complexe portal lui-même qui détermine la stabilité du virus en ce qui concerne la rétention du génome. »
« La chose la plus excitante ici est que nous avons montré, pour la première fois, comment la pression de l’ADN affecte la stabilité du portal, qui détermine finalement la stabilité du virus dans le temps à n’importe quelle température. » – Alex Evilevitch
Pour cette étude, Evilevitch et son équipe ont examiné la stabilité du complexe portal dans trois, virus différents – deux virus qui infectent les bactéries (Lambda et P22) et un qui infecte les cellules humaines (HSV-1). Ces trois virus contiennent de l’ADN double brin qui exerce une pression sur la paroi de la capside.
À l’aide d’un nouveau test de microcalorimétrie à balayage différentiel qu’ils ont mis au point, les chercheurs ont chauffé les échantillons de virus et détecté la température à laquelle la porte s’ouvre pour libérer l’ADN. Cette température reflète la stabilité mécanique de la porte.
Pour chaque type de virus qu’ils ont étudié, les chercheurs ont créé des souches mutantes de ce virus en faisant varier la longueur de l’ADN emballé à l’intérieur, créant ainsi des mutants avec différentes pressions internes. Les résultats des tests ont révélé que les mutants ayant plus d’ADN emballé et donc plus de pression, libéraient leur ADN à travers le portail à une température plus basse. Cette découverte suggère que la force mécanique du génome poussant contre le portail du virus le déstabilise et le rend susceptible de se briser.
En outre, l’équipe de recherche a comparé la température de libération de l’ADN pour les trois différents types de virus. Les résultats ont révélé une augmentation de la stabilité du portail pour les virus qui ont des génomes plus longs et donc des pressions plus élevées à l’intérieur.
« Nos résultats suggèrent que le complexe du portail a évolué pour résister à la force vers l’extérieur du génome emballé, équilibré contre l’exigence de libération efficace de l’ADN pendant l’infection », a déclaré Evilevitch. « Une compréhension plus approfondie de cet équilibre entre la pression interne et la stabilité du portail offre de nouvelles perspectives pour interférer avec la réplication virale, ainsi que pour concevoir des vecteurs viraux pour la thérapie génique qui peuvent retenir de manière stable un acide nucléique étranger. »
En plus d’Evilevitch et de Bauer, les chercheurs impliqués dans le projet comprennent : Dong Li de la CMU ; Fred Homa et Jamie Huffman de l’école de médecine de l’université de Pittsburgh ; Kasandra Wilson, Justin Leavitt et Sherwood Casjens de l’école de médecine de l’université de l’Utah ; et Joel Baines de l’école de médecine vétérinaire de l’université d’État de Louisiane.
Cette recherche a été financée par le Conseil suédois de la recherche et la National Science Foundation (CHE-1152770 à AE) avec un soutien supplémentaire des subventions du Service de santé publique et une subvention de formation des National Institutes of Health.