9.4 : Pourquoi ne peut-on pas voir les molécules?
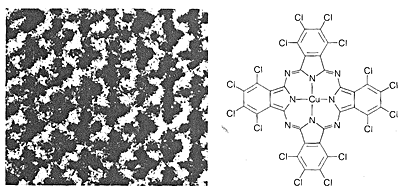
La façon la plus directe de déterminer les structures des molécules serait de « voir » comment les noyaux sont disposés et comment les électrons sont distribués. Cela n’est pas possible avec la lumière visible, car les longueurs d’onde de la lumière visible sont très largement supérieures aux dimensions moléculaires habituelles. Un faisceau d’électrons peut avoir les courtes longueurs d’onde requises, mais les petites molécules organiques sont rapidement détruites par l’irradiation avec des électrons de longueur d’onde appropriée. Néanmoins, la microscopie électronique est une technique précieuse pour l’étude de grandes molécules, comme l’ADN, qui peuvent être colorées avec des atomes de métaux lourds avant d’être visualisées, ou qui sont elles-mêmes raisonnablement stables à un faisceau d’électrons (Figures 9-4 et 9-5).

Virtuellement toutes les parties du spectre du rayonnement électromagnétique, des rayons X aux ondes radio, ont une certaine application pratique pour l’étude des molécules organiques. L’utilisation de la diffraction des rayons X pour déterminer la structure des molécules dans les cristaux est particulièrement utile et, au cours des dix dernières années, cette technique est devenue presque routinière. La figure 9-6 montre la disposition détaillée des carbones, des hydrogènes et des bromes dans le 1,8-bis(bromométhyl)naphtalène, \(1\), telle qu’elle a été déterminée par diffraction des rayons X. L’appareil et les techniques utilisés sont très complexes et ne sont pas encore disponibles pour de très nombreux laboratoires organiques.\(^3\)
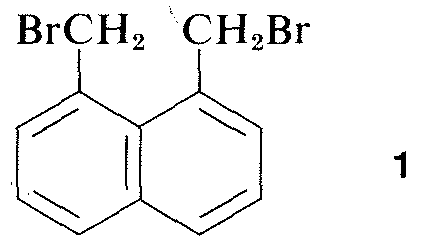
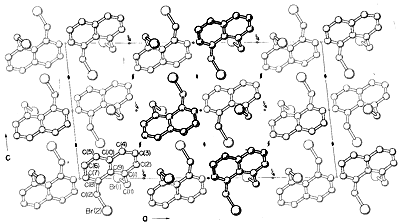
Les autres méthodes de diffraction comprennent la diffraction des électrons, qui peut être utilisée pour « déterminer les structures des gaz ou des substances liquides volatiles qui ne peuvent pas être obtenues sous forme de cristaux convenant à la diffraction des rayons X, et la diffraction des neutrons, qui a une application spéciale pour les cristaux dans lesquels l’emplacement exact des hydrogènes est souhaité. L’hydrogène n’a pas un pouvoir de diffusion suffisant pour que les rayons X puissent être localisés précisément par diffraction des rayons X.
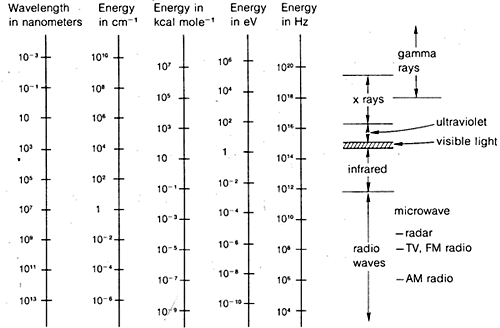
Les méthodes de diffraction peuvent être utilisées pour déterminer les structures complètes des molécules organiques, mais elles ne sont pas suffisamment routinières pour être utilisées généralement dans le travail pratique de laboratoire organique. C’est pourquoi, dans le reste de ce chapitre, nous mettrons l’accent sur les formes de spectroscopie qui sont généralement disponibles pour une utilisation de routine en laboratoire. Comme nous le verrons, ces méthodes sont utilisées par les chimistes organiques de manière plus ou moins empirique. En général, les méthodes spectroscopiques dépendent d’une certaine forme d’excitation des molécules par absorption d’un rayonnement électromagnétique et, comme nous l’avons dit, pratiquement toutes les parties du spectre électromagnétique sont utiles à cet égard. L’étendue du spectre électromagnétique couramment utilisée est illustrée à la figure 9-7 ainsi qu’une comparaison des diverses unités employées pour exprimer l’énergie ou la longueur d’onde.
Les principaux types de spectroscopie utilisés pour l’analyse structurale des composés organiques sont énumérés au tableau 9-1. La gamme de fréquences du rayonnement absorbé est indiquée, ainsi que l’effet produit par le rayonnement et le type spécifique d’information qui est utilisé dans l’analyse structurelle. Après un bref exposé des principes de la spectroscopie, nous décrirons les méthodes qui sont les plus utiles pour le travail pratique en laboratoire. Néanmoins, il est très important de connaître les autres méthodes, moins routinières, qui peuvent être utilisées pour résoudre des problèmes particuliers, et certaines d’entre elles sont abordées dans ce chapitre et dans les chapitres 19 et 27.
Vous pouvez avoir des problèmes avec les relations entre la variété des unités de longueur d’onde et de fréquence couramment utilisées en spectroscopie. La relation entre la longueur d’onde, la fréquence et la vitesse devrait devenir claire pour vous en vous imaginant debout sur une jetée regardant les vagues de l’océan passer. En supposant que les vagues sont uniformément espacées, il y aura une distance uniforme entre les crêtes, soit \(\lambda\), la longueur d’onde. Les crêtes des vagues passent à un certain rythme par minute, soit \(\nu\), la fréquence. La vitesse, \(c\), à laquelle les crêtes passent devant vous est liée à \(\lambda\) et \(\nu\) par la relation \(c = \lambda \nu\).
Ce n’est pas vraiment très compliqué et cela s’applique aussi bien aux vagues d’eau qu’au rayonnement électromagnétique. Ce qui est presque inutilement compliqué, c’est la variété des unités couramment utilisées pour exprimer \(\lambda\) et \(\nu\) pour le rayonnement électromagnétique. L’un des problèmes est la tradition, l’autre le désir d’éviter les nombres très grands ou très petits. Ainsi, comme le montre la figure 9-7, nous pouvons être intéressés par des longueurs d’onde électromagnétiques dont la différence peut atteindre un facteur de \(10^{16}\). Comme la vitesse du rayonnement électromagnétique dans le vide est constante à \(3 \times 10^8 \ : \text{m sec}^{-1}\), les fréquences différeront du même facteur.
Les unités couramment utilisées pour la longueur d’onde sont les mètres (\(\text{m}\)), les centimètres (\(\text{cm}\)), les nanomètres (\(\text{nm}\)), et les microns (\(\mu\)). Dans le passé, les angströms (\(Å\)) et les millimicrons (\(\text{m} \mu m\)) étaient également assez largement utilisés.
\
\
\
\
Les unités de fréquence sont en cycles par seconde (cps) ou en hertz (\(\text{Hz}\)), qui sont équivalents (les radians par seconde sont largement utilisés par les physiciens).
Tableau 9-1 : Principales techniques spectroscopiques actuellement utilisées pour l’analyse de la structure moléculaire

\
\
\
\(^3\)Une description utile de la façon dont les structures moléculaires peuvent être déterminées par la « vision aux rayons X » est donnée au chapitre XI de Organic Molecules in Action par M. Goodman et F. Morehouse, Gordon and Breach, New York, 1973.
- John D. Robert et Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, deuxième édition. W. A. Benjamin, Inc. Menlo Park, CA. ISBN 0-8053-8329-8. Ce contenu est protégé par le droit d’auteur dans les conditions suivantes : » Vous êtes autorisé à reproduire, distribuer, afficher et exécuter cette œuvre à titre individuel, à des fins éducatives, de recherche et à des fins non commerciales, sous quelque format que ce soit. «