Actualidad
20 de julio, 2015
Los hallazgos proporcionan un nuevo objetivo potencial para interferir con el ciclo de vida viral
Por Jocelyn Duffy / 412-268-9982 / [email protected]
Todos los virus tienen cáscaras de resistencia industrial que rodean y protegen el material genético en su interior, permitiendo que las partículas virales permanezcan estables, infecciosas y capaces de propagarse. El biofísico de la Universidad Carnegie Mellon, Alex Evilevitch, y sus colegas han identificado el talón de Aquiles de esa dura envoltura.
Publicados en el Journal of Virology, la revista más importante en este campo, los hallazgos señalan la parte más débil de la envoltura viral y proporcionan un nuevo objetivo potencial para interferir en el ciclo de vida viral y para desarrollar vehículos de entrega de terapia génica estable.
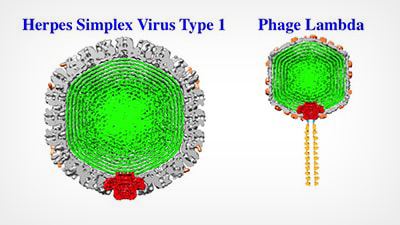
Los virus como el Herpes Simplex 1 y el Fago Lambda tienen una cubierta exterior resistente (gris) que encierra y protege el ADN viral (verde). Alex Evilevitch y sus colegas han identificado el talón de Aquiles de esa dura cubierta, el portal viral (rojo). Las imágenes de arriba son reconstrucciones de Cryo EM; el esquema del portal está superpuesto.
La cubierta exterior, llamada cápside, encierra el material genético de un virus. Los virus, como el virus del herpes simple tipo 1 (VHS-1), contienen ADN de doble cadena, cuyas largas hebras están fuertemente empaquetadas y ejercen una enorme presión, que alcanza decenas de atmósferas, sobre la pared interior de la cápside. En trabajos anteriores, Evilevitch midió por primera vez esta presión en el VHS-1; también ha demostrado que es esta presión la que propulsa el ADN fuera de un pequeño portal en la cápside del virus y hacia una célula huésped.
Con su última investigación, Evilevitch y el estudiante graduado de física David Bauer revelan que el portal es más que un simple conducto para el ADN. También es la parte estructural más débil de la cápside.
«Lo más emocionante aquí es que hemos demostrado, por primera vez, cómo la presión del ADN afecta a la estabilidad del portal, que en última instancia determina la estabilidad del virus a lo largo del tiempo a cualquier temperatura», dijo Evilevitch, profesor asociado de física y miembro del Centro de Mecánica e Ingeniería de Sistemas Celulares de la CMU.
El portal es un componente crítico de las cápsides virales. Formado por varias proteínas diferentes, el complejo portal empaqueta activamente el ADN durante el ensamblaje viral, libera el ADN durante la infección y, como revela la nueva investigación, es clave para mantener el delicado equilibrio de la cápside de ser lo suficientemente estable como para retener el genoma y, al mismo tiempo, lo suficientemente inestable como para permitir la liberación eficiente del genoma durante la infección.
«Experimentos anteriores han investigado el papel de la presión interna en la integridad estructural de las cápsides virales», dijo Evilevitch. «Aquí aportamos la primera prueba experimental de que es la fuerza mecánica del propio complejo portal la que determina la estabilidad del virus en lo que respecta a la retención del genoma.»
«Lo más emocionante aquí es que hemos demostrado, por primera vez, cómo la presión del ADN afecta a la estabilidad del portal, que en última instancia determina la estabilidad del virus a lo largo del tiempo a cualquier temperatura.» – Alex Evilevitch
Para este estudio, Evilevitch y su equipo observaron la estabilidad del complejo portal en tres virus diferentes: dos virus que infectan bacterias (Lambda y P22) y uno que infecta células humanas (HSV-1). Los tres virus contienen ADN de doble cadena que ejerce presión sobre la pared de la cápside.
Usando un novedoso ensayo de microcalorimetría de barrido diferencial que desarrollaron, los investigadores calentaron las muestras de virus y detectaron la temperatura a la que el portal se abre para liberar ADN. Esa temperatura refleja la estabilidad mecánica del portal.
Para cada tipo de virus que estudiaron, los investigadores crearon cepas mutantes de ese virus variando la longitud del ADN empaquetado en su interior, creando así mutantes con diferentes presiones internas. Los resultados de los ensayos revelaron que los mutantes con más ADN empaquetado y, por tanto, más presión, liberaban su ADN a través del portal a una temperatura más baja. Este hallazgo sugiere que la fuerza mecánica del genoma que empuja contra el portal del virus lo desestabiliza y lo hace propenso a abrirse.
Además, el equipo de investigación comparó la temperatura de liberación del ADN para los tres tipos diferentes de virus. Los resultados revelaron un aumento de la estabilidad del portal para los virus que tienen genomas más largos y, por lo tanto, tienen mayores presiones en su interior.
«Nuestros resultados sugieren que el complejo del portal ha evolucionado para soportar la fuerza exterior del genoma empaquetado en equilibrio con el requisito de la liberación eficiente del ADN durante la infección», dijo Evilevitch. «Una mayor comprensión de este equilibrio entre la presión interna y la estabilidad del portal ofrece nuevas perspectivas para interferir en la replicación viral, así como para diseñar vectores virales para la terapia génica que puedan retener de forma estable el ácido nucleico extraño.»
Además de Evilevitch y Bauer, los investigadores que participan en el proyecto son: Dong Li, de la CMU; Fred Homa y Jamie Huffman, de la Facultad de Medicina de la Universidad de Pittsburgh; Kasandra Wilson, Justin Leavitt y Sherwood Casjens, de la Facultad de Medicina de la Universidad de Utah; y Joel Baines, de la Facultad de Veterinaria de la Universidad Estatal de Luisiana.
Esta investigación fue financiada por el Consejo Sueco de Investigación y la Fundación Nacional de Ciencias (CHE-1152770 a AE) con el apoyo adicional de las subvenciones del Servicio de Salud Pública y una beca de formación de los Institutos Nacionales de Salud.