9.4. ¿Por qué no podemos ver las moléculas? ¿Por qué no podemos ver las moléculas?
La forma más directa de determinar las estructuras de las moléculas sería «ver» cómo están dispuestos los núcleos y cómo están distribuidos los electrones. Esto no es posible con la luz visible, porque las longitudes de onda de la luz visible son mucho más largas que las dimensiones moleculares habituales. Un haz de electrones puede tener las longitudes de onda cortas necesarias, pero las moléculas orgánicas pequeñas se destruyen rápidamente al irradiarlas con electrones de las longitudes de onda adecuadas. No obstante, la microscopía electrónica es una técnica valiosa para el estudio de moléculas grandes, como el ADN, que pueden teñirse con átomos de metales pesados antes de su visualización, o son ellas mismas razonablemente estables a un haz de electrones (Figuras 9-4 y 9-5).

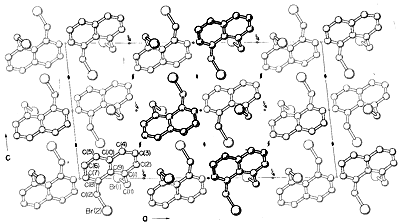
Casi todas las partes del espectro de la radiación electromagnética, desde los rayos X hasta las ondas de radio, tienen alguna aplicación práctica para el estudio de las moléculas orgánicas. El uso de la difracción de rayos X para la determinación de las estructuras de las moléculas en los cristales es de particular valor, y en los últimos diez años esta técnica se ha convertido casi en una rutina. La figura 9-6 muestra la disposición detallada de los carbonos, hidrógenos y bromos en el 1,8-bis(bromometil)naftaleno, \(1\), determinada por difracción de rayos X. El aparato y las técnicas utilizadas son muy complejas y todavía no están disponibles para muchos laboratorios orgánicos.^3\3
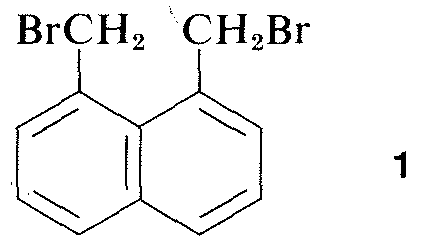
Otros métodos de difracción incluyen la difracción de electrones, que se puede utilizar para’determinar las estructuras de los gases o de las sustancias líquidas volátiles que no se pueden obtener como cristales adecuados para la difracción de rayos X, y la difracción de neutrones, que tiene una aplicación especial para los cristales en los que se desea la ubicación exacta de los hidrógenos. El hidrógeno no tiene suficiente poder de dispersión para que los rayos X puedan ser localizados con precisión por difracción de rayos X.
Los métodos de difracción pueden utilizarse para determinar las estructuras completas de las moléculas orgánicas, pero no son lo suficientemente rutinarios como para ser utilizados de forma general en el trabajo práctico de laboratorio orgánico. Por esta razón, en el resto de este capítulo enfatizaremos aquellas formas de espectroscopia que están generalmente disponibles para el uso rutinario del laboratorio. Como se verá, estos métodos son utilizados por los químicos orgánicos de forma más o menos empírica. En general, los métodos espectroscópicos dependen de alguna forma de excitación de las moléculas por absorción de radiación electromagnética y, como hemos dicho, prácticamente todas las partes del espectro electromagnético tienen utilidad en este sentido. En la figura 9-7 se muestra la franja del espectro electromagnético comúnmente utilizada, junto con una comparación de las diversas unidades que se emplean para expresar la energía o la longitud de onda.
Los principales tipos de espectroscopia utilizados para el análisis estructural de los compuestos orgánicos se enumeran en la tabla 9-1. Se muestra el rango de frecuencias de la radiación absorbida, así como el efecto producido por la radiación y el tipo específico de información que se utiliza en el análisis estructural. Tras una breve exposición de los principios de la espectroscopia, describiremos los métodos de mayor utilidad para el trabajo práctico de laboratorio. No obstante, es muy importante conocer otros métodos menos rutinarios que pueden utilizarse para resolver problemas especiales, y algunos de ellos se analizan en este capítulo y en los capítulos 19 y 27.
Es posible que tenga problemas con las relaciones entre la variedad de unidades de longitud de onda y frecuencia que se utilizan habitualmente en espectroscopia. La relación entre la longitud de onda, la frecuencia y la velocidad debería resultarle clara si considera que está de pie en un muelle observando el paso de las olas del mar. Suponiendo que las olas están uniformemente espaciadas, habrá una distancia uniforme entre las crestas, que es \(\lambda\), la longitud de onda. Las crestas de las olas pasarán a un cierto número por minuto, que es \(\nu\), la frecuencia. La velocidad, \(c\), a la que pasan las crestas está relacionada con \(\lambda\) y \nu\) por la relación \(c = \lambda\nu\).
Esto no es realmente muy complicado y se aplica igualmente a las ondas de agua o a la radiación electromagnética. Lo que sí es casi innecesariamente complicado es la variedad de unidades que se utilizan habitualmente para expresar \lambda y \nu para la radiación electromagnética. Un problema es la tradición, el otro es el deseo de evitar números muy grandes o muy pequeños. Así, como muestra la figura 9-7, podemos estar interesados en longitudes de onda electromagnéticas que difieren hasta en un factor de \(10^{16}\). Como la velocidad de la radiación electromagnética en el vacío es constante en \(3 \times 10^8 \: \text{m seg}^{-1}\), las frecuencias diferirán en el mismo factor.
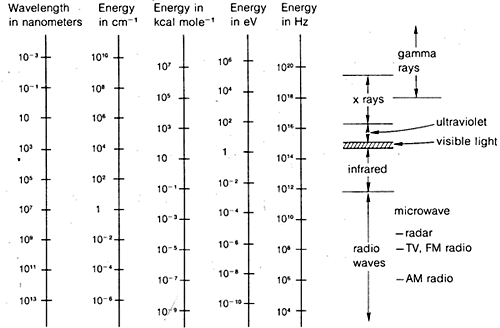
Las unidades comúnmente utilizadas para la longitud de onda son los metros (\(\text{m}\)), los centímetros (\(\text{cm}\)), los nanómetros (\(\text{nm}\)) y las micras (\(\mu)). En el pasado, los angstroms (\(Å\)) y los milimicrones (\text{m} \mu m\)) también se usaban bastante.
\
\️
\️
\️
Las unidades de frecuencia se expresan en ciclos por segundo (cps) o en hertzios (\️{Hz}\️), que son equivalentes (los radianes por segundo son muy utilizados por los físicos).
Tabla 9-1: Principales técnicas espectroscópicas utilizadas actualmente para el análisis de la estructura molecular

\N
\N5233>
\N5233>
(^3\N)Una descripción útil de cómo se pueden determinar las estructuras moleculares mediante la «visión de rayos X» se da en el capítulo XI de Organic Molecules in Action de M. Goodman y F. Morehouse, Gordon and Breach, Nueva York, 1973.
- John D. Robert y Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, segunda edición. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Este contenido está protegido por derechos de autor bajo las siguientes condiciones: «Se le concede permiso para la reproducción individual, educativa, de investigación y no comercial, la distribución, la exhibición y la ejecución de esta obra en cualquier formato.»